作者|@吕子睿 编辑|@江 南
我们在之前有关司美鲁肽的介绍文章中,已经简单介绍过降糖药物的新靶点—胰高血糖素样肽-1受体激动剂。
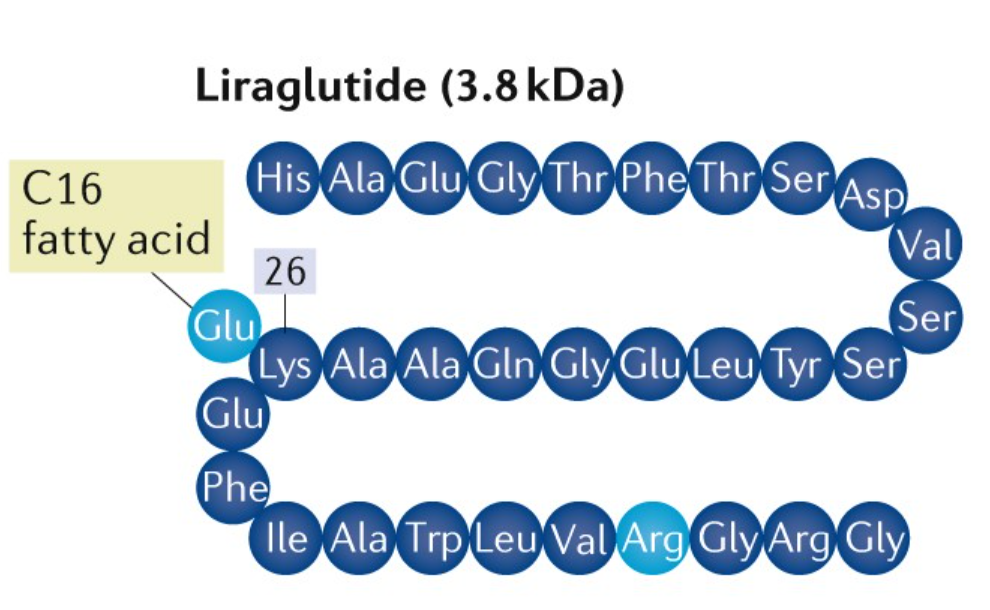
利拉鲁肽(Liraglutide)注射液,商品名为Victoza®(诺和力®),为丹麦诺和诺德公司开发的一种人胰高血糖素样肽-1(GLP-1)类似物类降糖药物。通过将人GLP-1的Lys34替换成Arg,并且在Lys26侧链上连接一条16碳棕榈脂肪酸(N-ε-(γ-Glu(N-α-十六酰基))),利拉鲁肽的稳定性显著提高,半衰期延长至13小时,降糖效果持续时间超24小时,每日只需皮下注射一次。

(来源:Andersen A, Lund A, Knop FK, Vilsbøll T. Glucagon-like peptide 1 in health and disease. Nat Rev Endocrinol. 2018;14(7):390-403.)
图1.利拉鲁肽结构示意图
2009年,利拉鲁肽率先在欧洲上市;2010,FDA批准了利拉鲁肽用于治疗成人2型糖尿病患者的上市申请;
2017年,FDA继续批准了利拉鲁肽用于降低2型糖尿病患者心脏病发作、卒中及心血管死亡风险;
2019年6月,FDA又批准扩展适应症,用于治疗10岁以上的2型糖尿病患者。
此外,临床实验中,利拉鲁肽还显示出减肥、改善肥胖相关合并症的潜力,2014年诺和诺德推出利拉鲁肽减肥针剂Saxenda(liraglutide,3mg),使其成为第一款被批准用于减肥的GLP-1类似物。
截至目前,Victoza®已在全球100多个国家获批,治疗2型糖尿病患者人数超过120万。自上市后,利拉鲁肽全球销售额逐年攀升,并于2018年达到销售额高峰—约37亿美元。但由于同类降糖药以及其他作用机制降糖药的竞争,2019年利拉鲁肽全球销售额开始下降,并被礼来的长效GLP-1类似物—度拉糖肽反超。

(来源:https://www.victozapro.com/)
图2. 利拉鲁肽注射液
2011年,利拉鲁肽获准进口注册,在我国上市,许可持有人为丹麦诺和诺德公司(Novo Nordisk A/S),商品名:Victoza®/诺和力®。但由于价格太高,诺和力在国内的销售情况并不乐观。


(来源:诺和诺德公司官网,https://www.novonordisk.com/)
图3. 诺和诺德公司Logo
2017年7月,诺和力®通过谈判成功进入医保目录,3ml:18mg规格的价格降至410元/支。进入医保后,诺和力®自2017年第三季度迎来明显放量,销售额也不断攀升。2018年,诺和力®销售额增长73%,达5.44亿人民币,占国内GLP-1市场87 %的市场份额,占整个糖尿病市场1.3 %的市场份额。

(来源:http://app1.nmpa.gov.cn/)
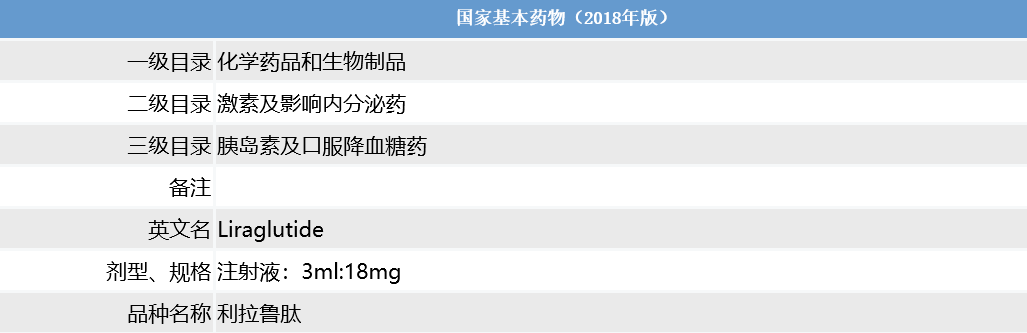
图4. 利拉鲁肽被纳入国家医保名录
此后,诺和力®成功续约2019年医保,国内的利拉鲁肽市场仍由诺和诺德一家独占。2020年5月14日,国家药品监督管理局(NMPA)批准了利拉鲁肽注射液(诺和力®)心血管(CV)获益适应症:“适用于降低伴有心血管疾病的2型糖尿病成人患者的主要心血管不良事件(心血管死亡、非致死性心肌梗死或非致死性卒中)风险。”这意味着利拉鲁肽将成为目前唯一获NMPA批准的具有降低心血管风险适应症的降糖药物。预计未来随着新适应症的获批,利拉鲁肽有望进一步迎来销售额新高。
LEADER研究结果—NMPA批准心血管(CV)获益适应症的主要依据
NMPA批准利拉鲁肽心血管获益新适应的申请,主要基于一项利拉鲁肽治疗的心血管结局的随机双盲临床研究—LEADER的结果。先将相关文献与大家分享如下:


(来源:Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016;375(4):311-322.)
图5. 原文文献标题截图
研究旨在探究利拉鲁肽,一种胰高血糖素样肽1类似物,在2型糖尿病患者的标准治疗过程中的心血管作用。研究由诺和诺德和美国国立卫生研究院资助;LEADER ClinicalTrials:NCT01179048。
LEADER研究为一项多国、多中心、随机、双盲、安慰剂对照的大型临床试验,共入选了32个国家(包括中国)的9340例T2DM患者,其中81.3 %患者有既往有心血管病史,18.7 %患者有高危心血管风险。这些受试者被随机分为标准治疗联合利拉鲁肽组或安慰剂组,研究平均随访3.8年。
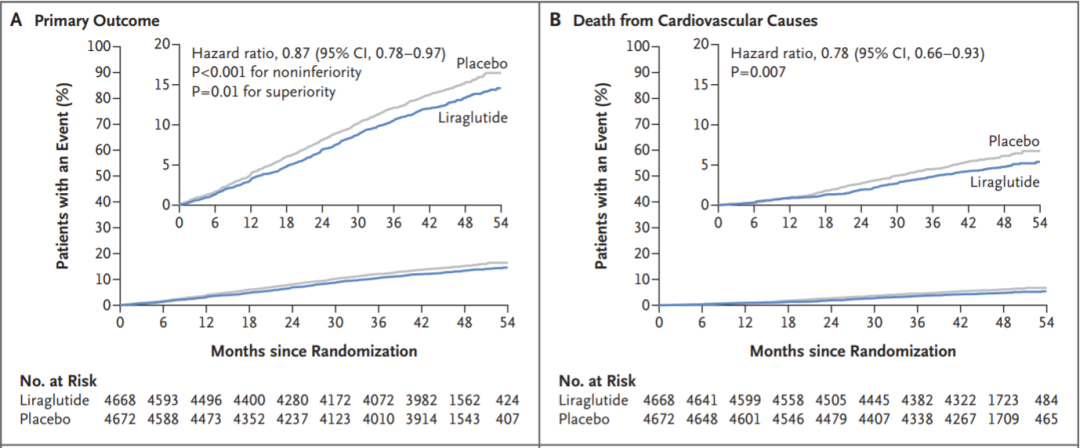
利拉鲁肽组患者主要心血管不良事件(心血管疾病、非致命性心肌梗死或非致命性中风)的发生率显著少于安慰剂组(608/4668,13.0% vs 694/4672,14.9%),危险比为0.87;95%可信区间[CI]为0.78~0.97(非劣效性P<0.001;优越性P = 0.01)。同时,利拉鲁肽组的心血管死亡风险降低,因心血管疾病死亡的患者比例显著少于安慰剂组(219例4.7 % vs 278例,6.0 %),危险比0.78(95%CI,0.66-0.93;P = 0.007)。

(来源:同图5.)
图6. 原文文献数据,不同受试组主要心血管不良事件及心血管死亡率变化
此外,相较于安慰剂组(447例,9.6%),利拉鲁肽组(381例,8.2 %)的全因死亡率更低(危险比为0.85;95%CI为0.74-0.97;P = 0.02);非致命性心梗的发生率和住院率也明显低于安慰剂组。

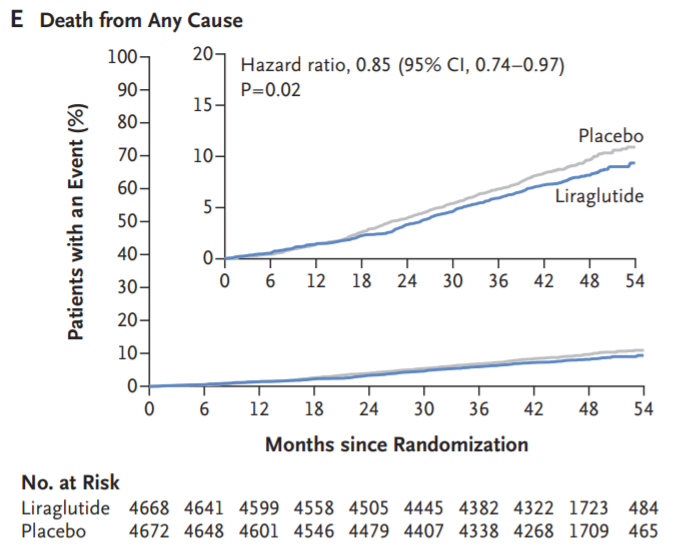
(来源:同图5.)
图7. 原文文献数据,不同受试组全因死亡率变化
在安全性方面,导致利拉鲁肽停药的最常见不良事件是胃肠道事件。利拉鲁肽组胰腺炎的发生率明显低于安慰剂组。

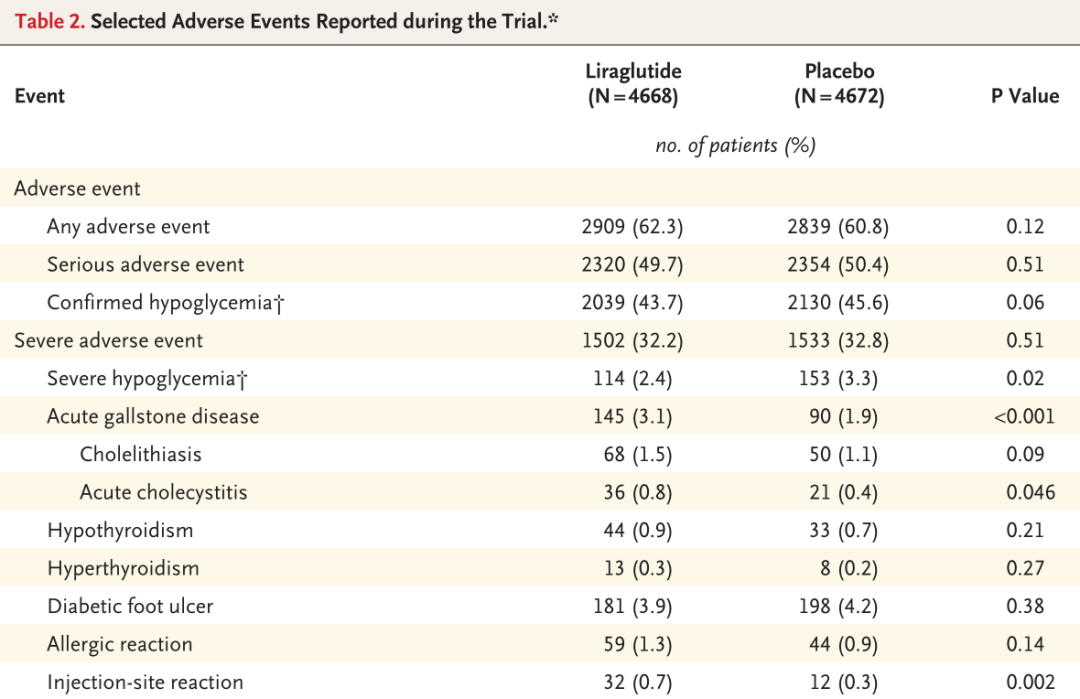
(来源:同图5.)
图8. 原文文献数据,不同受试组主要不良反应
利拉鲁肽为GLP-1RA类降糖药,每日皮下注射一次,由诺和诺德公司开发。该药于2011年进入国内市场,并在2017进入医保目录后销售额不断攀升。2018年,诺和力®占据了国内GLP-1市场87 %的份额,占整个糖尿病市场1.3 %的市场份额。LEADER临床研究表明,利拉鲁肽能够降低2型糖尿病患者的心血管死亡率及全因死亡率,基于此,NMPA于2020年5月14日批准了利拉鲁肽注射液(诺和力®)心血管(CV)获益适应症,使之成为目前唯一获NMPA批准的具有降低心血管风险适应症的降糖药物。预计未来随着新适应症的获批,利拉鲁肽有望进一步迎来销售额新高。
目前,诺和诺德依旧占据了利拉鲁肽的全部国内市场。不过,利拉鲁肽化合物专利在国内于2017年8月到期,晶体专利于2022年到期。目前国内已有多家企业布局该领域,其中深圳市健翔生物制药、成都圣诺生物制药、深圳翰宇药业公司已向药审中心提交了4类仿制药上市申请,重庆派金生物和正大天晴在进行BE试验,广东东阳光、通化东宝和杭州九源基因工程处于III期临床阶段。预计未来随着国产利拉鲁肽的获批上市,诺和力将面临更加激烈的竞争。
参考文献:
1. Andersen A, Lund A, Knop FK, Vilsbøll T. Glucagon-like peptide 1 in health and disease. Nat Rev Endocrinol. 2018;14(7):390-403.
2. Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016;375(4):311-322.
药物研究专辑
NASH
| | |
抑郁症
| | | | | |
上市公司研究
|
政策研究




 个人中心
个人中心
 我是园区
我是园区





