▎药明康德内容团队编辑
近日,艾伯维(AbbVie)宣布,美国FDA已批准白细胞介素-23(IL-23)抑制剂Skyrizi(risankizumab)扩展适应症,用于治疗活动性银屑病关节炎(PsA)成人患者。Skyrizi目前获批用于治疗中重度斑块状银屑病和PsA成人患者,通过单次注射给药,每年注射四次。它还在多项3期临床试验中接受评估,用于治疗克罗恩病和溃疡性肠炎等炎症疾病。

PsA是一种异质性的全身性炎症性疾病,影响大约30%的银屑病患者,在多个系统(包括关节和皮肤)具有标志性表现。免疫系统产生的炎症,可导致关节疼痛、疲劳、僵硬,并引起红色鳞屑性皮疹。Skyrizi通过与IL-23的p19亚基结合,能够选择性阻断IL-23。IL-23是一种参与炎症过程的细胞因子,被认为与许多慢性免疫介导的疾病有关,包括银屑病。

本次批准基于两项3期临床试验获得的积极数据。第一项试验在对至少一种改变疾病进展的抗风湿药物(DMARD)应答不足或不耐受的PsA患者中评估了Skyrizi的疗效和安全性,第二项试验则针对生物制品治疗和/或非生物制品DMARD治疗疗效不佳或不耐受的患者。
两项试验均达到其主要终点,在治疗第24周时,接受Skyrizi治疗的患者分别有57.3%和51.3%达到ACR20应答(表示疾病严重程度与基线相比降低至少20%),安慰剂组为33.5%和26.5%(p<0.001),并在PsA的几种其他症状(包括肿胀、压痛和疼痛关节)中表现出显著改善。
此外,试验也达到重要次要终点,患者的皮肤症状清除率(使用PASI 90测量)、身体功能(使用HAQ-DI指数检测)和最小疾病活动度(MDA)均得到明显改善。药物表现出的总体安全性特征与在斑块状银屑病患者中观察到的基本一致。具体数据请见下图:
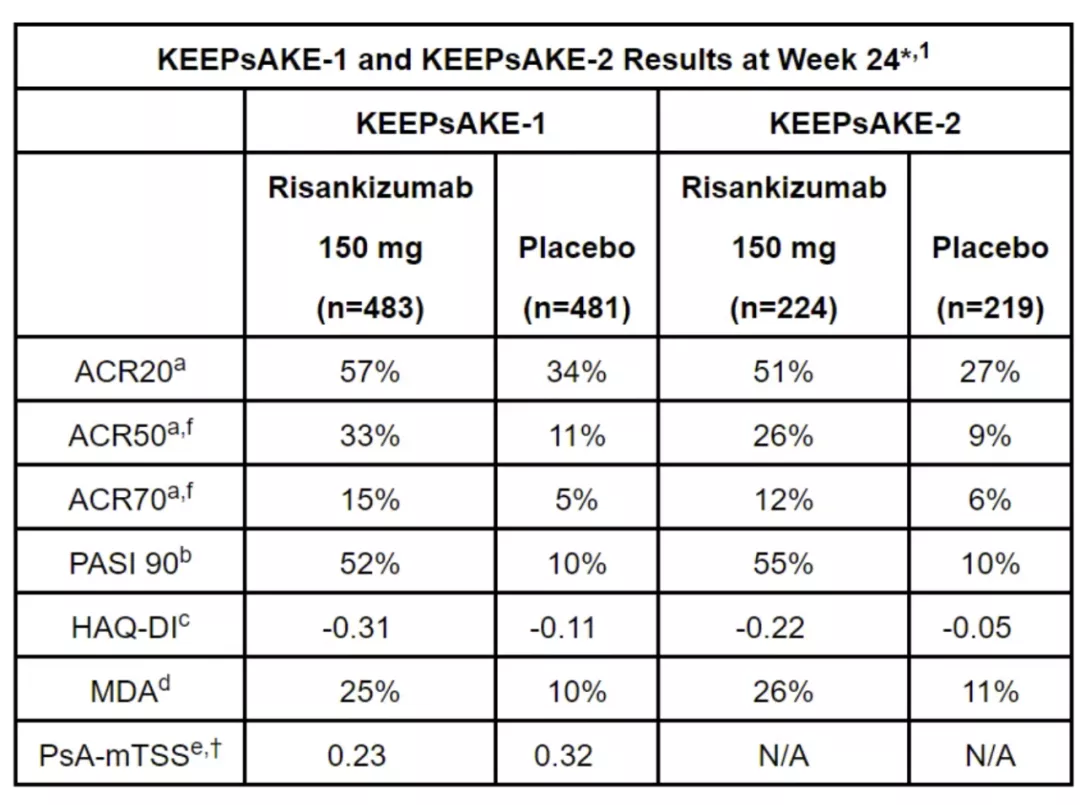
▲Skyrizi在两项3期临床试验中主要终点和次要终点的表现(图片来源:参考资料[2])
“在关键性3期临床试验中,Skyrizi表现出对许多银屑病关节炎症状的改善,包括关节疼痛、附着点炎(手指、脚趾和肌腱或韧带附着在骨头上的部位发炎)和指头炎。”试验主要研究者Alan J. Kivitz博士表示,“此次批准为皮肤科医生和风湿病学家提供了一个治疗选择,以帮助改善PsA患者的皮肤和关节症状,同时提供了一种季度给药方案,可能更适合患者的生活方式。”
参考资料:
[1] U.S. FDA Approves Second Indication for Skyrizi® (risankizumab-rzaa) to Treat Adults with Active Psoriatic Arthritis. Retrieved January 21, 2022, from https://news.abbvie.com/news/press-releases/us-fda-approves-second-indication-for-skyrizi-risankizumab-rzaa-to-treat-adults-with-active-psoriatic-arthritis.htm
[2] Risankizumab (SKYRIZI®) Phase 3 Results Demonstrate Improvements in Disease Activity Across Joint and Skin Symptoms Among Psoriatic Arthritis Patients. Retrieved January 5, 2021, from https://www.prnewswire.com/news-releases/risankizumab-skyrizi-phase-3-results-demonstrate-improvements-in-disease-activity-across-joint-and-skin-symptoms-among-psoriatic-arthritis-patients-301201081.html
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。









 个人中心
个人中心
 我是园区
我是园区




