
2021年11月,Nature上刊载了一篇名为“Tumour DDR1 promotes collagen fibre alignment to instigate immuneexclusion”的研究,该研究相关专利已授权给初创生物技术公司ParthenonTherapeutics。
在论文发表当日,Parthenon宣布获得由辉瑞等领投的6500万美元A轮融资, 与这家biotech一同冉冉升起的是盘状结构域受体1(DDR1)。
DDR1概览
DDR家族是一组独特的受体酪氨酸激酶(RTKs),由DDR1和DDR2组成,可以调节各种细胞信号通路、细胞增殖、粘附、迁移和基质重塑。DDR在多种恶性肿瘤中高度表达,如肺癌、乳腺癌、卵巢癌、胰腺癌等。
DDR1结构中存在一些主要的结构域,包括位于细胞外区域的N端DS结构域,它与各种胶原蛋白结合,下面是类似球状的盘状结构域(DS-like)。在DS-like下面,是胞外并膜(EJXM)结构域,大约50个氨基酸残基;之后是TM结构域、细胞膜或胞内并膜(IJXM),IJXM大约有171个氨基酸残基;IJXM之后是酪氨酸KD,包含300多个氨基酸残基;DDR1在IJM结构域有7个酪氨酸残基,在KD有8个酪氨酸残基,总共有15个酪氨酸残基;最后是C末端尾巴。
DDR1有5个异构体,即DDR1a,DDR1b,DDR1c,DDR1d和DDR1e。其中DDR1a,DDR1b和DDR1c是含有KD的激酶活性,是全长的功能性受体;DDR1d和DDR1e由于截断或移位,是无功能的受体。DDR1a包含876个氨基酸残基,DDR1b 含有913个残基,而DDR1c在所有的异构体中是最长的,含有919个残基。DDR1d由IJM结构域的第11和第12外显子的缺失形成508个残基,从而导致了框架转换突变,产生了截断、无活性的蛋白。DDR1e包含767个残基 第11和第12外显子缺失,同时含有KD部分,但三磷酸腺苷(ATP)结合位点不存在,因此不会发生自动磷酸化。
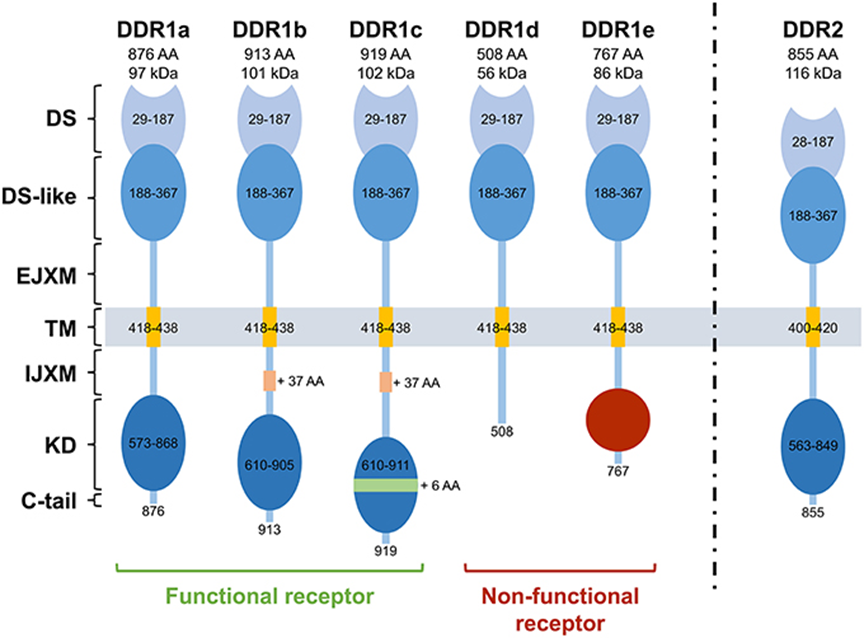
DDR结构图[3]
DDR作为独特的RTKs,其独特之处在于其需要与螺旋状态的胶原蛋白结合才能激活,脊椎动物中共有28种胶原蛋白(I-XXVIII),DDR1主要与I, IV, V, VI和VIII型胶原蛋白结合。在胶原蛋白与DS结构域结合后,DDR1发生自磷酸化,各种下游信号途径被激活。
信号通路
在胶原蛋白与DS结构域结合后,Src激酶对KD中的特定酪氨酸残基进行磷酸化,DDR1激活。研究表明,KD的残基磷酸化会导致IJM结构域中的其他几个酪氨酸残基的自动磷酸化,这些残基作为许多适应蛋白的结合点,即SHC转化蛋白1或SHC转化蛋白A。其他包括Nck2、酪氨酸磷酸酶蛋白或SHP-2,C-末端的Src激酶,非肌球蛋白重链-IIA,焦点粘附激酶(FAK)的Pyk2,FAK超家族、NF-κB、Cdc42、丝氨酸活化蛋白激酶,AP-1,还有STAT家族的细胞内转录因子(STAT1a/b、STAT3和STAT5)。
DDR1在恶性肿瘤细胞中的信号传导途径包括Ras/Raf/ERK和PI3K/Akt途径,信号激活导致B细胞淋巴瘤特大基因的上调或过度表达,从而在乳腺癌或结肠癌细胞中产生抗凋亡和促生存信号。
有时,胶原蛋白诱导的DDR1激活与整合素的激活在各种下游信号级联中显示出协同作用,例如:
1)DDR1与整合素β1一起激活,在胰腺癌细胞系中启动FAK/p130CAS/JNK途径,导致细胞分散或上皮间质转化(EMT);
2)在MDA-MB-431和T47D乳腺癌细胞系中,DDR1的激活导致NF-κB基因同时激活,DNA结合活性增加,导致环氧化酶-2的过度表达,使其对化疗产生抗性并减少细胞凋亡。
3)胶原蛋白诱导的DDR1激活促进了HCT116人类结肠癌细胞系的Notch信号通路。该途径涉及到γ-分泌酶,它可以裂解Notch 1蛋白,生成Notch 1细胞内结构域,从而导致Hes1和Hey2准生存基因的上调,增加细胞的生存率。
4)DDR1能够抑制整合素STAT1/3途径介导的细胞迁移和整合素FAK-Cdc42途径介导的细胞扩散。
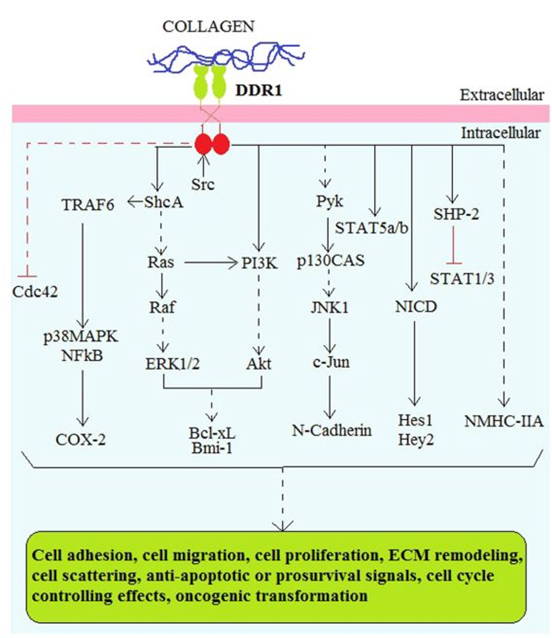
已有的研究表明,DDR在肺癌(NSCLC和SCC)、乳腺癌、鼻咽癌、肝癌和结直肠癌等癌症发展中均发挥重要作用。DDR作为新型抗癌药物发现的潜在靶标,可以采用几种抑制策略。
靶向DDR1胞内激酶结构域
使用各种小分子抑制剂如TKIs作用于KD结构域,目前几乎所有报道过的DDR TKIs都是ATP竞争性抑制剂(I型或II型)。目前FDA已批准的多靶点小分子RTK抑制剂,如 imatinib, nilotinib和dasatinib,也可阻断DDR1的激酶活性。
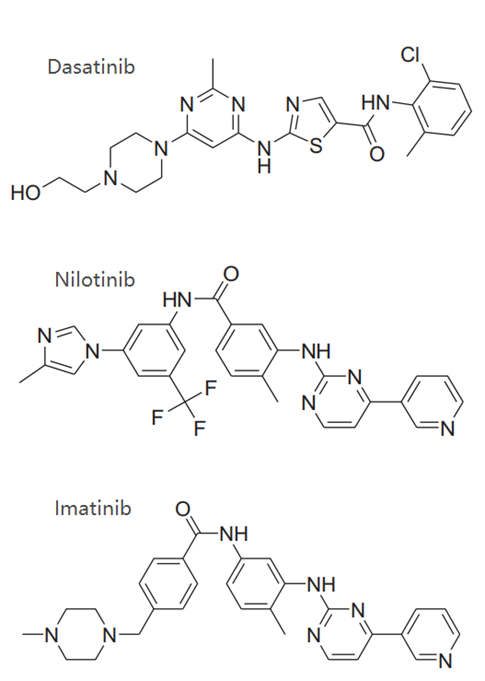
靶向DDR1胞外结构域
阻断胶原蛋白与DDR1的相互作用。Carafoli等人在2012年开发了一个抗DDR1单抗,通过与DS样结构域结合,抑制DDR1的激活,而不干扰胶原蛋白的结合。目前这款抗体已经没有什么后文了。
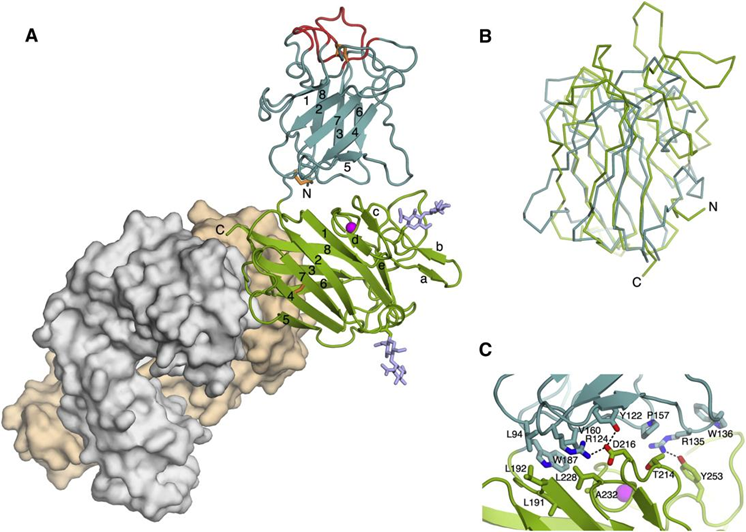
DDR1-3E3 Fab复合物晶体结构[4]
时间来到2019年,Yiran Tao等人开发了一种靶向DDR1的ADC(T4H11-DM4),已经证明在结肠癌小鼠模型中具有抗肿瘤作用并表现出可接受的安全性。其单抗作用于DDR1胞外区域的DS结构域,但不与胶原蛋白结合位点重叠。
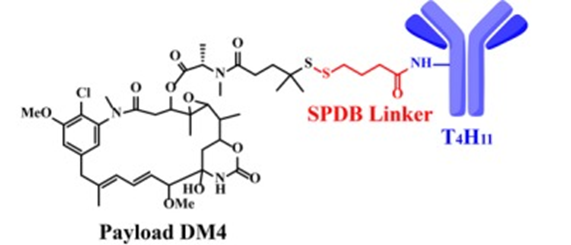
T4H11-DM4结构图
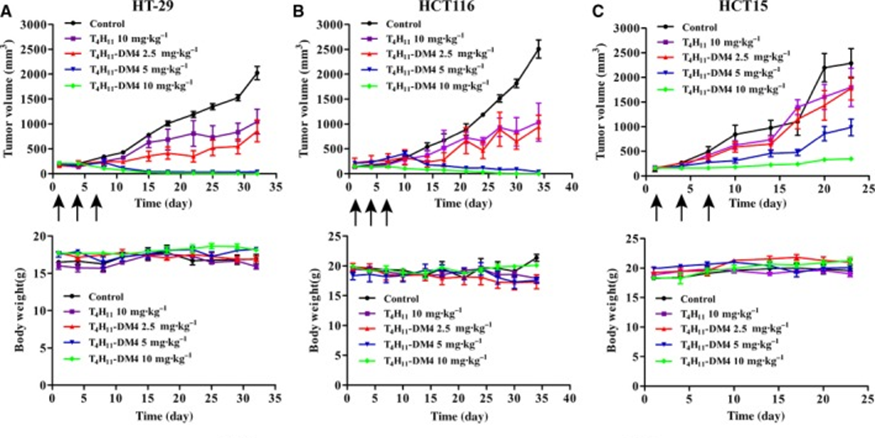
T4H11-DM4抗瘤效力
2021年11月3日,Nature上刊载的一项研究为DDR1抗癌疗法带来了新希望。

DDR1促进乳腺肿瘤生长、抑制抗肿瘤免疫细胞的浸润
研究人员敲除了三种TNBC小鼠模型中的DDR1,发现DDR1敲除(DDR1-KO)的小鼠肿瘤不会在体内生长。
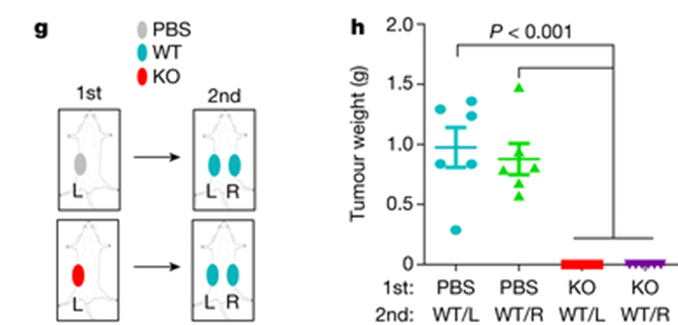
随后将免疫缺陷宿主中形成的移植瘤,移植入免疫完全的宿主,发现DDR1通过阻碍T细胞浸润,而不是影响其增殖或细胞毒性功能来促进肿瘤生长。同时DDR1的mRNA和蛋白水平与抗肿瘤免疫相关基因、肿瘤内T细胞聚集的基因表达特征、CD8+T细胞特征评分以及细胞溶解效应通路都呈现负相关。
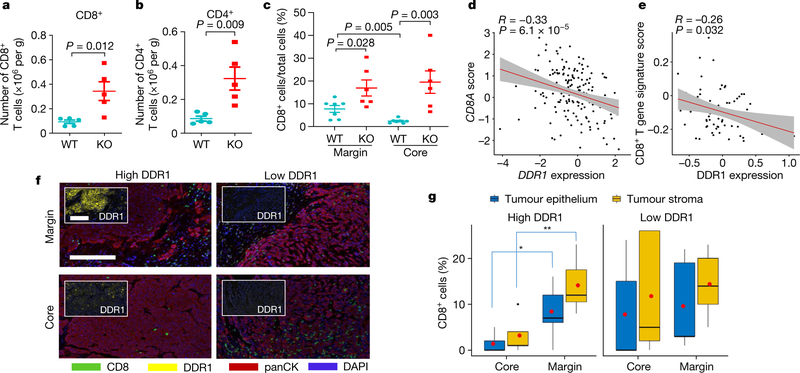
DDR1胞外域(DDR1-ECD)通过胞外基质(ECM)重塑来抑制免疫细胞浸润
研究人员在DDR1-KO肿瘤细胞中异位表达DDR1突变体,发现缺乏跨膜和激酶结构域的DDR1-ECD能够促进Ddr1-KO肿瘤的生长,而那些胶原蛋白结合缺陷的突变体的促肿瘤能力下降。表明DDR1与胶原蛋白的结合是促肿瘤生长所必需的。同时,在DDR1敲除细胞中仅恢复DDR1-ECD就能够恢复对T细胞的抑制。

DDR1作为肿瘤免疫治疗新靶点的潜力
研究人员开发了靶向huDDR1-ECD单克隆抗体,发现在DDR1-KO肿瘤细胞中表达huDDR1,能够抑制免疫活性宿主中肿瘤生长和体外T细胞迁移,但在免疫缺陷宿主无抑制作用,表明该抗体主要抑制DDR1介导的免疫排斥反应。
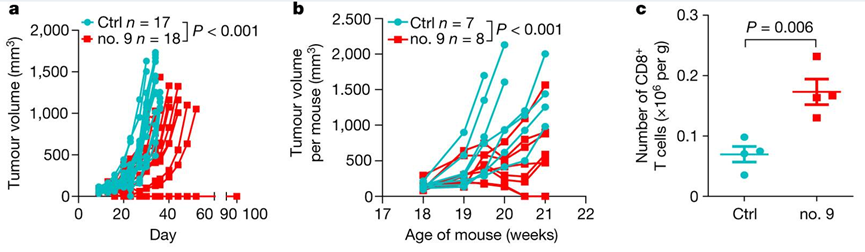
该研究揭示了无膜DDR1-ECD在基于胶原纤维的抗肿瘤免疫机制中的作用。其开发的靶向DDR1中和抗体能破坏肿瘤屏障,促进免疫细胞浸润,破坏肿瘤细胞。

目前,该研究专利已授权给Parthenon Therapeutics公司,该公司基于此项研究开发新型DDR1抗体PRTH-101。
该公司在文章发表当日即宣布获得由Northpond Ventures, 辉瑞风险投资和Taiho Ventures公司领投的6500万美元A轮融资。
免责声明



 个人中心
个人中心
 我是园区
我是园区




