
点评 | 段树民(中国科学院院士)、韩峰(南京医科大学)
小胶质细胞调控中枢稳态的机制是近年来的研究热点,功能异常的小胶质细胞是导致神经退行性疾病的原因之一。作为脑内最主要的免疫细胞,小胶质细胞通过吞噬对神经元进行修饰,参与调控神经元新生、神经环路重塑、以及突触修剪。然而没有明确的证据表明小胶质细胞能够直接影响神经元的膜电兴奋性。
2022年7月20日,来自浙江大学医学院附属第二医院/浙江大学转化医学研究院史鹏研究组与浙江大学基础医学院沈啸和谷岩研究团队合作在Immunity杂志上发表了题为
Microglia-derived PDGFB promotes neuronal potassium currents to suppress basal sympathetic tonicity and limit hypertension
的文章,
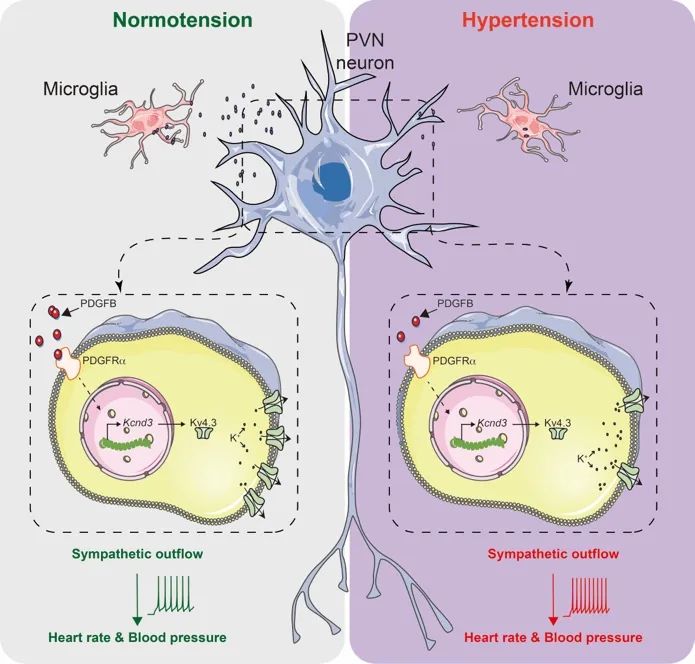
发现静息态下的小胶质细胞通过旁分泌PDGFB直接作用于下丘脑室旁核(PVN)前交感(pre-sympathetic)神经元上的PDGFR受体,促进该神经元中一种钾通道蛋白的表达,从而防止神经元超兴奋,维持正常的交感神经张力和血压。
小鼠高血压模型下该通路被扰乱,造成持续性的交感高张,进一步加剧了高血压的进展。

心血管疾病是我国以及全球范围内排名第一的致死性和致残性疾病
【1】
。然而,针对心血管疾病治疗的药物研发在过去的二十年中不足癌症药物开发的十分之一。举例而言,虽然在诸多心血管疾病的独立风险因素中高血压位列榜首
【2】
,但是最新获得FDA批准的降压药还停留在2007年诺华公司研发的Aliskiren
(肾素抑制剂)
,距今15年该领域再无抗高血压新药问世。临床报道90%以上的高血压属于病因不明的原发性高血压,而大部分原发性高血压患者具有交感高张,且对部分难治型高血压患者实施肾交感消融术
(Renal nerve denervation)
可以有效缓解高血压症状
【3】
。然而,中枢交感神经相关神经元的稳态如何被调控是长期以来领域里的难点。
该研究发现去除静息态的小胶质细胞会造成小鼠自主神经功能异常,表现为心率加快、心率变异度降低
(heart rate variability)
、以及减压反射敏感度
(baroreflex sensitivity)
和外周去甲肾上腺素升高,提示交感神经张力升高。通过膜片钳对下丘脑室旁核中投射到脑干头端腹侧延髓
(RVLM)
的前交感神经元
(简称PVN-RVLM)
进行电生理分析,发现去除了静息态的小胶质细胞极大的抑制了一过性外向钾电流
(IA)
,导致PVN-RVLM神经元的电活性增加和交感输出增多。
通过对PVN-RVLM神经元进行单细胞测序,发现小胶质细胞的缺失导致介导IA电流的钾离子通道编码亚基的Kcnd3表达减少。共培养实验表明小胶质细胞是通过旁分泌的形式对神经元中该基因进行直接调控。为了解析小胶质细胞通过何种介质维持神经元中Kcnd3的表达,作者重点分析了成年小鼠静息态小胶质细胞转录本中高表达的分泌型蛋白,发现血小板生长因子B
(Pdgfb)
在小胶质细胞中表达显著高于脑内其他类型细胞
(包括脑内的边界巨噬细胞)
。特异性去除小胶质细胞中的Pdgfb可以再现去除小胶质细胞后的自主神经功能紊乱以及电生理特性。相反,在小胶质细胞缺失的小鼠中外源性补给重组PDGFB蛋白有效的缓解了上述表型,提示小胶质细胞中的PDGFB是维持神经元中Kv4.3
(Kcnd3基因编码蛋白)
表达的必要因素。而这一作用是否是PDGFB对神经元的直接影响呢?接下来,作者通过特异性敲降PVN-RVLM神经元中的PDGFR
(而非PDGFR)
,证明了这一小胶质细胞→神经元的直接旁分泌作用。
接下来,研究者进一步探究是否小胶质细胞对神经元的调控异常是导致高血压下交感神经亢奋的原因。研究者发现多种高血压小鼠模型中小胶质细胞的PDGFB表达以及PVN-RVLM神经元中的Kv4.3表达均显著下调。去除小胶质细胞中的Pdgfb或者外源性补给重组PDGFB蛋白均可以改变高血压的进程。提示这一通路的受损参与了交感高张和血压的升高。PDGFR受体属于酪氨酸激酶
(Tyrosine kinase receptor)
家族成员,其抑制剂是临床中广泛使用的抗肿瘤药物之一,通过抑制血管新生达到抗肿瘤的效果。临床报告该类激酶抑制剂
(tyrosine kinase inhibitor [
TKI
])
的使用会造成高血压这一不良反应
【4,5】
。Immunity报道的这项研究发现,正常小鼠给予TKI类药物pazopanib后会出现PVN-RVLM神经元钾电流降低、交感高张、高血压的表型,与临床报道极为相似。通过在PVN-RVLM神经元中过表达Kv4.3能起到拮抗pazopanib诱导的升压效果,明确了TKI类药物导致血压升高这一不良反应的细胞分子机制。
综上所述,
这项工作首次揭示了静息态的小胶质细胞通过不断旁分泌PDGFB控制神经元超兴奋这一全新的中枢稳态调控机制,从而达到维持正常的交感神经活性以及心血管功能稳态,丰富了对脑内两种细胞间交互作用的认识。
本课题得到了浙江大学医学院附属浙江医院脑科中心刘小利、万曙、李力主任医师,浙江大学医学院汪仪研究员,浙江大学生物医学工程与仪器科学学院赵立研究员,以及西安交通大学医学部徐佳曦研究员的支持和帮助。
史鹏研究员课题组长期致力于脑内自主神经参与心血管以及神经退行性疾病的机制研究,在Circulation Research, Hypertension, Stroke,Pharmacological Research,Science Immunology等一系列心血管以及免疫专业期刊发表学术论文三十多篇。通过综合应用心血管以及神经电生理功能分析,系统解析正常以及病理进程中对下丘脑室旁核(PVN)前交感神经元活性的调控机制,揭示作为维持神经内分泌稳态的关键中枢核团,PVN如何参与外周心血管功能以及免疫调控。在此诚挚邀请对该方向感兴趣研究生以及博士后加盟。
 段树民 院士
(浙江大学)
⼩胶质细胞是中枢神经系统的主要免疫细胞,作为清道夫清理神经系统微环境⾥的各种废物、异物以及参与损伤后修复。独特的是,近来的研究揭⽰了⼩胶质细胞还通过吞噬神经元或神经⼲细胞参与胚胎期脑发育,以及维持成年后中枢神经元稳态
(调控神经元的可塑性neuronal plasticity)
。后者已知的机制是通过补体系统的C1q识别需要清除的神经元或者神经突触并进⾏修剪
(pruning)
。修剪能够改变神经元树突棘
(spine)
密度,重塑神经元环路的连接,从⽽改变神经元活性。在炎症情况下⼩胶质细胞也可以通过释放炎症介质调控神经元活性。然⽽,在正常静息情况
(steady state)
下⼩胶质细胞是否也广泛地通过旁分泌作⽤调控神经元活性还不清楚。浙江大学转化医学院/浙江大学医学院附属第二医院的史鹏团队在对这一问题研究时发现在静息态下小胶质细胞能够通过旁分泌PDGFB维持神经元K通道蛋白的表达,从而调控神经元膜电位,避免活性过激。这是首次报道小胶质细胞直接参与神经元膜电位稳态的直接证据,大大丰富了对神经元-小胶质细胞之间cross-talk途径的认识,并且进一步的分析发现该机制具有脑区普遍性。该研究的另一个亮点是进一步揭示了自主神经活性稳态的中枢调控机制。交感神经几乎遍及全身所有组织器官,以往的研究着重于反馈环路对交感神经以及其支配的各组织脏器的功能影响。而该项研究揭示了交感神经稳态的中枢调控机制,发现小胶质细胞这一中枢的免疫细胞能够长期稳定地调控交感神经相关神经元的活性。尤其是考虑到越来越多的研究提示交感神经对外周免疫细胞在炎症疾病中的作用,该研究提示了免疫细胞对交感神经元的影响,对二者交互作用提供了重要补充。
段树民 院士
(浙江大学)
⼩胶质细胞是中枢神经系统的主要免疫细胞,作为清道夫清理神经系统微环境⾥的各种废物、异物以及参与损伤后修复。独特的是,近来的研究揭⽰了⼩胶质细胞还通过吞噬神经元或神经⼲细胞参与胚胎期脑发育,以及维持成年后中枢神经元稳态
(调控神经元的可塑性neuronal plasticity)
。后者已知的机制是通过补体系统的C1q识别需要清除的神经元或者神经突触并进⾏修剪
(pruning)
。修剪能够改变神经元树突棘
(spine)
密度,重塑神经元环路的连接,从⽽改变神经元活性。在炎症情况下⼩胶质细胞也可以通过释放炎症介质调控神经元活性。然⽽,在正常静息情况
(steady state)
下⼩胶质细胞是否也广泛地通过旁分泌作⽤调控神经元活性还不清楚。浙江大学转化医学院/浙江大学医学院附属第二医院的史鹏团队在对这一问题研究时发现在静息态下小胶质细胞能够通过旁分泌PDGFB维持神经元K通道蛋白的表达,从而调控神经元膜电位,避免活性过激。这是首次报道小胶质细胞直接参与神经元膜电位稳态的直接证据,大大丰富了对神经元-小胶质细胞之间cross-talk途径的认识,并且进一步的分析发现该机制具有脑区普遍性。该研究的另一个亮点是进一步揭示了自主神经活性稳态的中枢调控机制。交感神经几乎遍及全身所有组织器官,以往的研究着重于反馈环路对交感神经以及其支配的各组织脏器的功能影响。而该项研究揭示了交感神经稳态的中枢调控机制,发现小胶质细胞这一中枢的免疫细胞能够长期稳定地调控交感神经相关神经元的活性。尤其是考虑到越来越多的研究提示交感神经对外周免疫细胞在炎症疾病中的作用,该研究提示了免疫细胞对交感神经元的影响,对二者交互作用提供了重要补充。
 韩峰 教授
(南京医科大学)
高血压在>60岁人群中的发病率高到三分之二,是导致血管性认知功能障碍以及阿尔茨海默病(AD)的重要心血管病因。高血压的本质是基于阻力血管收缩导致的血流动力学紊乱,长期血压升高会引起脑内微小血管结构以及功能的改变,譬如脑血管内皮功能异常和神经-血管单元耦合障碍,导致脑内血流灌注不足。另外,长期高血压可破坏血脑屏障,导致神经炎症的发生,加重淀粉样蛋白沉积。临床影像学发现高血压患者脑内出现小血管病变
(如脑白质损伤、腔隙性梗塞、微小梗死灶)
,并与认知功能下降呈现正相关。多项前瞻性和回顾性研究发现:中年人群
(40~44岁)
高血压的患病极大的增加了老年痴呆的发生。高血压导致认知功能障碍的机制目前并不明确。作为一种老年病,高血压促进脑内炎症和超氧化物的蓄积,这些也是加剧AD病理进程的因素之一。小胶质细胞作为脑内主要的免疫细胞,在高血压和AD中均显著性被激活,极有可能参与并桥梁这两种疾病的进程。Immunity最新一期的研究报道了以浙江大学医学院转化医学研究院史鹏研究员团队为主的一项工作,通过一系列经典的心血管以及神经电生理分析,明确了小胶质细胞来源的PDGFB直接调控神经元中编码钾电流离子通道蛋白基因Kcnd3的表达;揭示了脑内的小胶质细胞通过旁分泌的形式参与调控交感神经神经元电活性,进而影响外周交感神经张力以及自主神经功能。高血压中这一通路的受损/下调导致了神经元兴奋性升高以及外周自主神经功能紊乱。这与临床中应用靶向PDGF受体家族的酪氨酸激酶抑制剂导致的高血压现象相呼应,部分的解释了这一临床现象。同时也为自主神经功能异常的机制研究提供了崭新的思路。史鹏研究员团队本研究项目的创新之处在于:1)为外周心血管危险因素与认知功能障碍的临床表型之间的关联性提供了精确的神经血管单元损伤病理调控机制;2)围绕脑内不同类型细胞间通讯调控的国际难点问题,在小胶质细胞与神经元通讯的研究方法和策略上取得重要突破。期待该团队围绕小胶质细胞的行为学特性调控这一切入点,后续能进一步开展相关药物靶标确证工作,期望为改善或者缓解心血管危险因素诱发的认知功能损伤提供临床解决方案。
https://doi.org/10.1016/j.immuni.2022.06.018
韩峰 教授
(南京医科大学)
高血压在>60岁人群中的发病率高到三分之二,是导致血管性认知功能障碍以及阿尔茨海默病(AD)的重要心血管病因。高血压的本质是基于阻力血管收缩导致的血流动力学紊乱,长期血压升高会引起脑内微小血管结构以及功能的改变,譬如脑血管内皮功能异常和神经-血管单元耦合障碍,导致脑内血流灌注不足。另外,长期高血压可破坏血脑屏障,导致神经炎症的发生,加重淀粉样蛋白沉积。临床影像学发现高血压患者脑内出现小血管病变
(如脑白质损伤、腔隙性梗塞、微小梗死灶)
,并与认知功能下降呈现正相关。多项前瞻性和回顾性研究发现:中年人群
(40~44岁)
高血压的患病极大的增加了老年痴呆的发生。高血压导致认知功能障碍的机制目前并不明确。作为一种老年病,高血压促进脑内炎症和超氧化物的蓄积,这些也是加剧AD病理进程的因素之一。小胶质细胞作为脑内主要的免疫细胞,在高血压和AD中均显著性被激活,极有可能参与并桥梁这两种疾病的进程。Immunity最新一期的研究报道了以浙江大学医学院转化医学研究院史鹏研究员团队为主的一项工作,通过一系列经典的心血管以及神经电生理分析,明确了小胶质细胞来源的PDGFB直接调控神经元中编码钾电流离子通道蛋白基因Kcnd3的表达;揭示了脑内的小胶质细胞通过旁分泌的形式参与调控交感神经神经元电活性,进而影响外周交感神经张力以及自主神经功能。高血压中这一通路的受损/下调导致了神经元兴奋性升高以及外周自主神经功能紊乱。这与临床中应用靶向PDGF受体家族的酪氨酸激酶抑制剂导致的高血压现象相呼应,部分的解释了这一临床现象。同时也为自主神经功能异常的机制研究提供了崭新的思路。史鹏研究员团队本研究项目的创新之处在于:1)为外周心血管危险因素与认知功能障碍的临床表型之间的关联性提供了精确的神经血管单元损伤病理调控机制;2)围绕脑内不同类型细胞间通讯调控的国际难点问题,在小胶质细胞与神经元通讯的研究方法和策略上取得重要突破。期待该团队围绕小胶质细胞的行为学特性调控这一切入点,后续能进一步开展相关药物靶标确证工作,期望为改善或者缓解心血管危险因素诱发的认知功能损伤提供临床解决方案。
https://doi.org/10.1016/j.immuni.2022.06.018
制版人:十一
1. Zhao, D., Liu, J., Wang, M., Zhang, X., and Zhou, M. (2019). Epidemiology of cardiovascular disease in China: current features and implications. Nat Rev Cardiol 16, 203-212.
2. McClellan, M., Brown, N., Califf, R.M., and Warner, J.J. (2019). Call to Action: Urgent Challenges in Cardiovascular Disease: A Presidential Advisory From the American Heart Association. Circulation 139, e44-e54.
3. Azizi, M., Sanghvi, K., Saxena, M., Gosse, P., Reilly, J.P., Levy, T., Rump, L.C., Persu, A., Basile, J., Bloch, M.J., et al. (2021). Ultrasound renal denervation for hypertension resistant to a triple medication pill (RADIANCE-HTN TRIO): a randomised, multicentre, single-blind, sham-controlled trial. Lancet 397, 2476-2486.
4. Azizi, M., Chedid, A., and Oudard, S. (2008). Home blood-pressure monitoring in patients receiving sunitinib. N Engl J Med 358, 95-97.
5. Escalante, C.P., and Zalpour, A. (2011). Vascular endothelial growth factor inhibitor-induced hypertension: basics for primary care providers. Cardiol Res Pract 2011, 816897.
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。



 段树民 院士
(浙江大学)
段树民 院士
(浙江大学)
 韩峰 教授
(南京医科大学)
韩峰 教授
(南京医科大学)





 个人中心
个人中心
 我是园区
我是园区




