

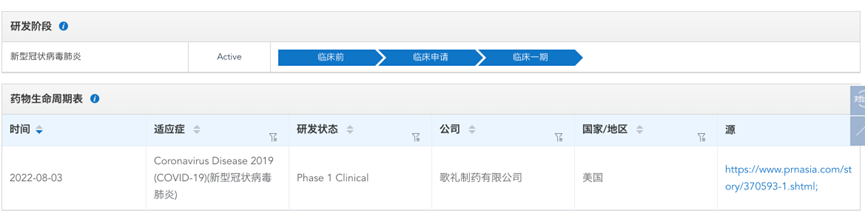
2022年8月3日,歌礼制药宣布其口服RdRp抑制剂ASC10已获得FDA批准在轻度至中度新冠患者中开展随机,安慰剂对照的Ib期临床研究。
ASC10是一款由歌礼完全自主研发的口服双前药,同单前药莫努匹韦(molnupiravir)相比具有新的差异化的化学结构。口服给药后,ASC10和莫努匹韦均可在体内快速、完全转换为相同的活性代谢物ASC10-A,也称β-D-N4-羟基胞苷(NHC)。
通过采用双前药策略,ASC10在Caco-2细胞(人结直肠腺癌细胞)中的渗透性和在猴子中的活性代谢物暴露量分别达到了莫努匹韦的3.2倍和2.1倍。在感染新冠病毒的小鼠模型中,ASC10在240毫克/公斤剂量每日给药两次的情况下降低老鼠肺组织中病毒滴度4.0对数值,与莫努匹韦在500毫克/公斤剂量下每日给药两次取得的效果一致。
来源:药渡数据库
根据歌礼制药公告,FDA建议其直接在轻度至中度新冠患者中开展ASC10首个临床试验,无需开展健康受试者临床试验。
根据药渡数据调研,此项研究是一项随机、安慰剂对照的Ib期临床试验,旨在确定多剂量递增(200毫克、400毫克或800毫克,每日两次)的ASC10片剂在轻度至中度新冠患者中的安全性、耐受性、药代动力学和初步疗效数据,治疗期为5.5天,观察期为28天。此前,莫努匹韦获得FDA紧急使用许可的剂量为800毫克每日两次。
在8月4日,歌礼制药宣布NMPA已经受理其新药临床试验,但具体内容并未公开。

在刚过去7月,国内迎接了首款国产新冠口服药物阿兹夫定片的上市。阿兹夫定是一种通过阻断病毒RNA 复制来抑制新冠病毒的RdRp抑制剂。

来源:nature
显著改善临床症状方面
阿兹夫定片可以显著缩短中度的新型冠状病毒感染肺炎患者症状改善时间,提高临床症状改善的患者比例,达到临床优效结果:首次给药后第7天临床症状改善的受试者比例阿兹夫定组40.43%,安慰剂组10.87%(P值<0.001),受试者临床症状改善的中位时间阿兹夫定组与安慰剂组有极显著统计学差异(P值<0.001)。
抑制病毒方面
阿兹夫定具有抑制新冠病毒的活性,病毒清除时间为5天左右。
安全性方面
阿兹夫定片总体耐受性良好,不良事件发生率阿兹夫定组与安慰剂组无统计学差异,未增加受试者风险。
除了真实生物的阿兹夫定、默沙东的的莫奈拉韦,还有君实生物的VV116也同为以RdRp为靶点的新冠口服药,此外还有多种同针对RdRp靶点的新冠口服药在研,根据西南证券统计,共有9款在研/上市的治疗新冠的口服RdRp抑制剂。君实生物的VV116距离上市最近。
以上还只是关于靶向RdRp的新冠口服药的讨论,还没有提及以辉瑞为代表的口服SARS-CoV-2 Mpro抑制剂的竞争。尽管疫情常态化是一个趋势,但此时入场新冠口服药还来得及吗?不得不对歌礼发出灵魂拷问。
参考资料
1.歌礼制药公告以及公众号
免责声明



 个人中心
个人中心
 我是园区
我是园区




