
责编 | 兮
哺乳动物的环核苷酸门控离子通道(cyclic nucleotide-gated channels, CNG channels)在视觉和嗅觉感受系统的信号转导过程中发挥重要作用。光线变化和气味分子分别被视锥/视杆细胞和嗅感觉神经元细胞膜表面的受体识别后,细胞内的环核苷酸水平发生变化,进而调控CNG通道的开放或者关闭【1】。
与细胞质中环核苷酸(cGMP或cAMP)结合后,CNG通道发生构象变化,从而打开离子传导路径 【2】。在哺乳动物中,CNG离子通道家族包含6个同源组分:4个A亚基(A1–A4)和2个B亚基(B1、B3)。其中A1、A2、A3亚基各自可形成有功能的同源四聚体,常用于研究CNG通道的生理特征。但是自然状态下的CNG离子通道是由A和B亚基组成的异源四聚体 【3】。虽然CNGB亚基单独不能形成有功能的离子通道,但是赋予了自然状态CNG离子通道独特的功能特性。
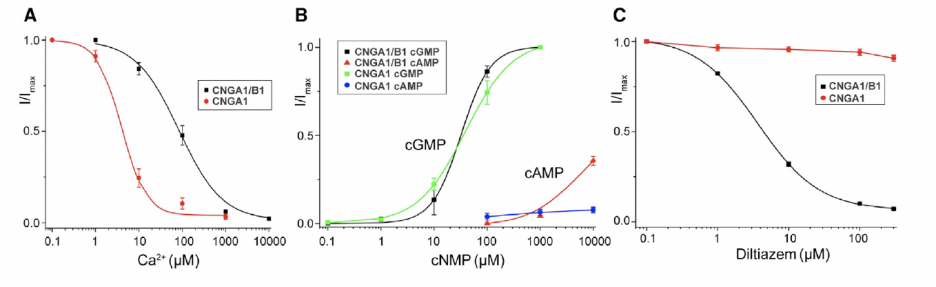
视杆细胞中自然状态的离子通道CNGA1/B1与同源四聚体CNGA1具有不同的生理特征。CNGA1/B1具有更弱的钙阻塞现象;除了能够被cGMP完全激活外,CNGA1/B1还可以被高浓度的cAMP部分激活;L-cis-Diltiazem可以有效阻塞CNGA1/B1,而对CNGA1的阻塞效应却很弱【3,4】 (图1)。虽然人源CNGA1同源四聚体的结构已经被解析【5】,但是CNGB1结构信息的缺乏导致这些独特生理特性的分子机制还不清楚。
2021年10月25日,来自德克萨斯大学西南医学中心的姜有星课题组在Neuron杂志发表文章Structural mechanisms of assembly, permeation, gating, and pharmacology of native human rod CNG channel,解析了人源视杆细胞CNGA1/B1离子通道不同状态下的三维结构(Apo、cGMP-bound open、cAMP-bound closed和L-cis-Diltiazem-blocked),揭示了自然状态CNG离子通道具有独特的离子渗透、门控调节、药理学特征以及3:1比例组装的结构基础。

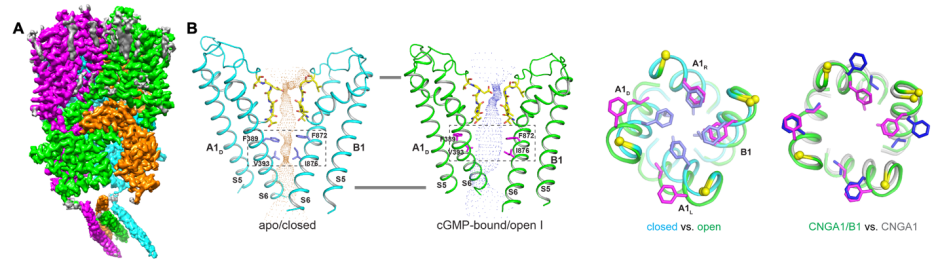
研究人员首先通过特殊的方式共表达CNGA1和CNGB1亚基,纯化得到了均一的以3:1 比例组装的 CNGA1:CNGB1的异源四聚体,进而利用冷冻电镜技术解析了其不同状态下的三维结构。CNGA1/B1具有和CNGA1同源四聚体相似的整体结构。离子传导路径上B1独特的氨基酸残基减弱了CNGA1/B1的钙阻塞和单通道电导。在CNGA1/B1的CNBD结构域的下方, 三个A1亚基的 CLZ结构域形成3-helix coiled coil结构,与一个B1亚基的α-螺旋相互作用,揭示了A1:B1以3:1比例进行组装的结构基础(图2A)。
在Apo关闭状态的CNGA1/B1异源四聚体中, A1和B1的门控氨基酸侧链都位于孔道中间,阻碍离子通过;但是在cGMP结合的开放状态,只有两个A1亚基的门控氨基酸侧链向孔道外侧翻转,而另外一个A1亚基和B1亚基的门控氨基酸侧链只发生轻微的向外移动,没有发生翻转,这就造成了不对称的通道开放。与对称开放的CNGA1同源四聚体相比,CNGA1/B1具有更窄的离子传导路径(图2B)。
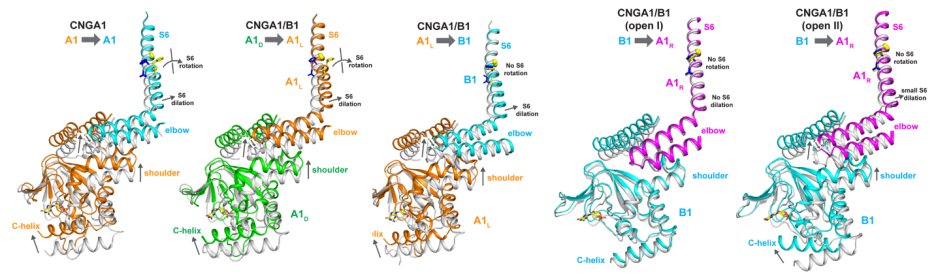
cGMP结合的样品呈现出两种不同的开放状态。这两种状态具有相似的不对称开放孔道,但是B1亚基的CNBD结构域处于不同的构象。与关闭状态的结构相比较, CNGA1/B1中四个亚基的CNBD结构域与cGMP结合后发生构象变化,但将这种变化传递并最终引起离子孔道螺旋S6变化的能力不同,这就造成了虽然四个亚基都可以结合配体,但是只有两个A亚基的门控进入开放状态(图3)。由于cAMP对CNGA1/B1的激活效率非常低,虽然cAMP结合的三维结构得以解析,但是却处于关闭状态,因此cAMP激活的结构机制尚不清楚。
为了揭示自然状态CNG离子通道独特药力学特性的结构基础,作者还解析了CNGA1/B1和L-cis-Diltiazem复合物的结构。L-cis-Diltiazem结合在开放孔道中央,B1亚基没有提供任何特别的相互作用,但是CNGA1/B1独有的不对称的门控结构为L-cis-Diltiazem创造了一个完美的开放空间,L-cis-Diltiazem通过疏水相互作用稳定其中,这也解释了为什么CNGA1同源四聚体不能结合L-cis-Diltiazem。
总的来说,通过解析不同状态的CNGA1/B1离子通道的结构,揭示了其独特组装方式、离子渗透、门控机制和药理特性的结构基础。关闭状态下CNGA1/B1异源四聚体和CNGA1同源四聚体具有相似的结构;cGMP与CNGA1/B1结合引起构象变化,但是四个亚基传递构象变化并引起孔道螺旋S6变化的能力不同,造成CNGA1/B1不对称的门控开放,而这种不对称的门控又是其独特药理学特性的结构基础。
原文链接:
https://www.cell.com/neuron/fulltext/S0896-6273(21)00774-1
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。
参考文献
1. Bradley, J., Reisert, J., and Frings, S. (2005). Regulation of cyclic nucleotide-gated channels. Curr Opin Neurobiol 15, 343-349.
2. Varnum, M.D., and Zagotta, W.N. (1996). Subunit interactions in the activation of cyclic nucleotide-gated ion channels. Biophys J 70, 2667-2679.
3. Kaupp, U.B., and Seifert, R. (2002). Cyclic nucleotide-gated ion channels. Physiol Rev 82, 769-824.
4. Chen, T.Y., Peng, Y.W., Dhallan, R.S., Ahamed, B., Reed, R.R., and Yau, K.W. (1993). A new subunit of the cyclic nucleotide-gated cation channel in retinal rods. Nature 362, 764-767.
5. Haynes, L.W. (1992). Block of the cyclic GMP-gated channel of vertebrate rod and cone photoreceptors by l-cis-diltiazem. J Gen Physiol 100, 783-801.
6. Xue, J., Han, Y., Zeng, W., Wang, Y., and Jiang, Y. (2021). Structural mechanisms of gating and selectivity of human rod CNGA1 channel. Neuron 109, 1302-1313 e1304.




 个人中心
个人中心
 我是园区
我是园区




