
日前,真固生物关联公司及全球战略合作伙伴——Pillar Biosciences 宣布,其 Onco Reveal™ Dx 肺癌结直肠癌基因检测试剂盒获得美国食品药品监督管理局(FDA)上市批准。该产品是一种基于组织的 NGS 伴随诊断检测试剂盒,用于检测非小细胞肺癌(NSCLC)和结肠直肠癌(CRC)DNA 中的体细胞突变。这也是 FDA 批准的第一个基于第二代基因组测序技术(NGS)的跨癌种伴随诊断试剂盒,同时也是获得 FDA 和 CE 双认证的第一款肿瘤 NGS-IVD 跨癌种伴随诊断试剂盒。另外真固生物 NMPA 试剂盒也预计在年底获批(时间轴见文末),这也将预示着真固生物的全球化布局进入新里程!
真固生物和 Pillar 的共同创始人、首席执行官宋钢博士表示:
「我们致力于提供优质精准的检测 IVD,以便为癌症患者做出更好的治疗决策。我们获得 FDA 批准的产品能用于任何开展 NGS 检测的实验室,让癌症患者都能获得精准医疗。」

图片来源:FDA 官网 [1]
OncoReveal™ Dx 肺癌结直肠癌基因检测试剂盒介绍
FDA 批准 OncoReveal™ Dx 作为指导非小细胞肺癌(NSCLC)患者 EGFR TKI 疗法和转移性结直肠癌(mCRC)患者 Erbitux®(西妥昔单抗)或 Vectibix®(帕尼妥单抗)靶向治疗的伴随诊断试剂盒(CDx)。该试剂盒使用 Illumina® 因美纳公司的 MiSeqDx™ 仪器进行测序。

U.S.A - FDA-Approved
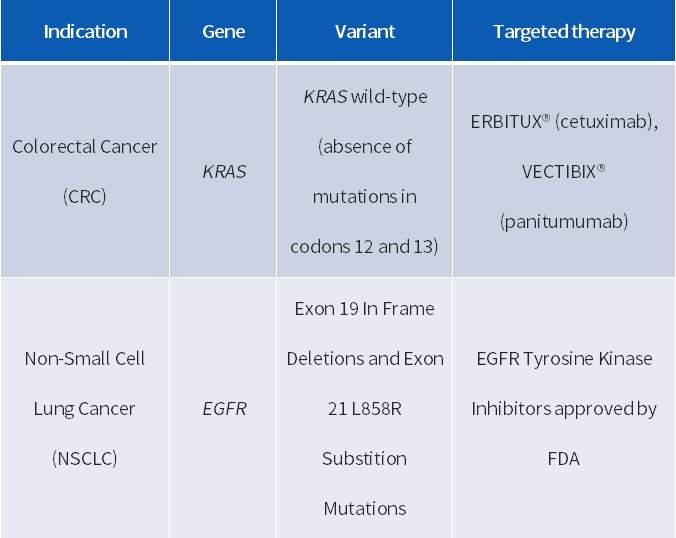
表格来源:Pillar Biosciences[2]
Europe and other countries/regions accept CE Mark
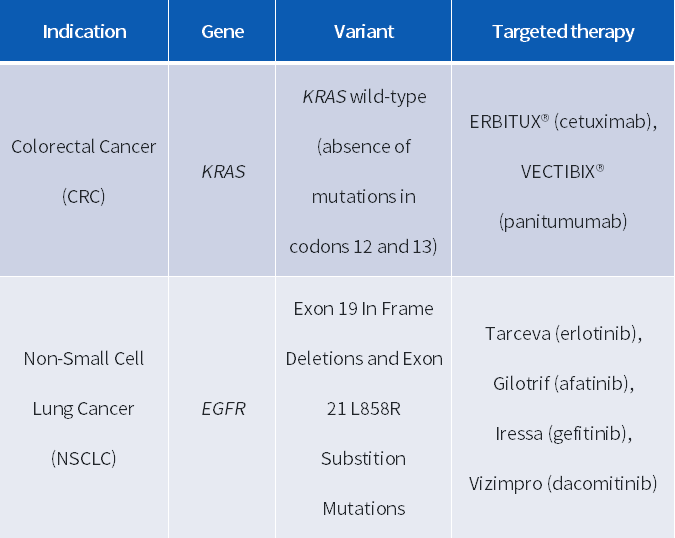
表格来源:Pillar Biosciences[3]
01
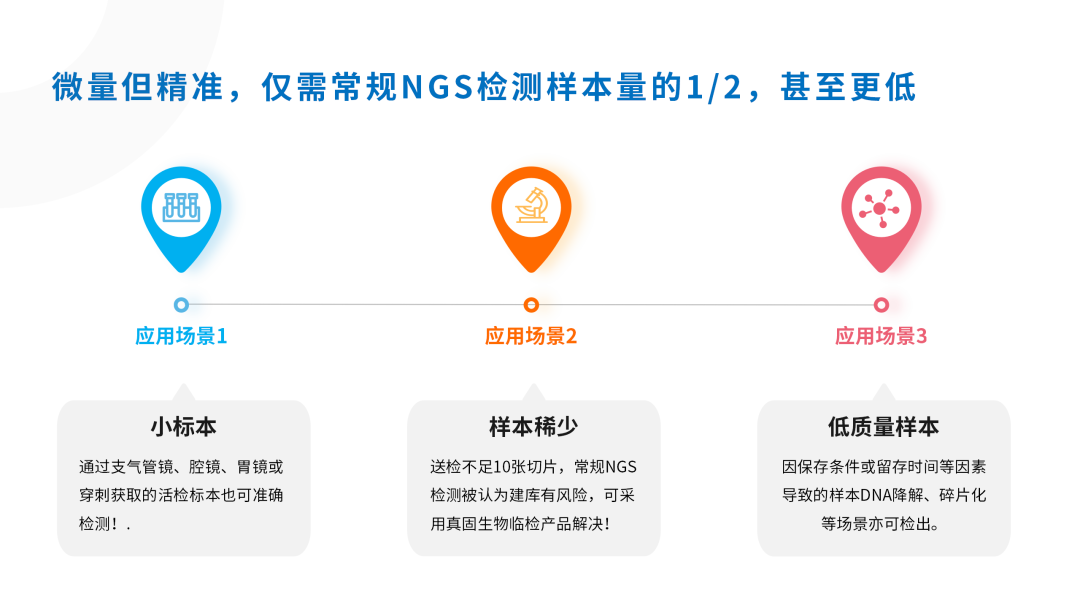
真固生物临检产品优势:
用科技守护标本,助力个体化精准诊疗!

02
真固生物临检产品总览:
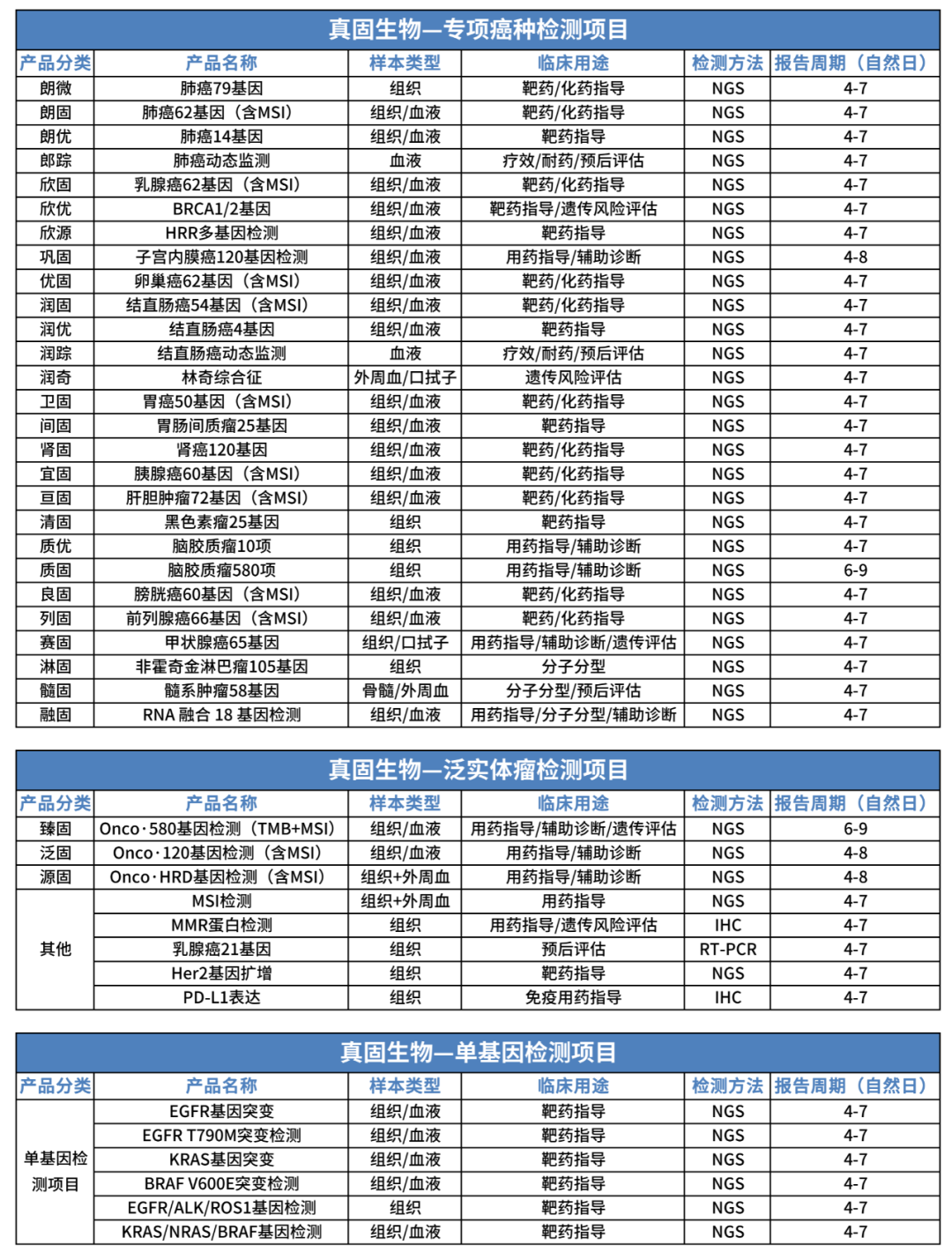
以上产品仅限科研合作使用,主要样本来源于上海真固生物科技有限公司 LDT 试剂入院合作的客户,提供建库测序生信分析。
Pillar Biosciences 是一家全球肿瘤解决方案公司,提供准确、可靠、及时、临床可操作的体外诊断试剂盒(IVD),助力实现肿瘤的精准的个体化诊疗。我们的使命是让患者在离家更近的地方享受高质量、高性价比的专业临床级 NGS 检测服务。Pillar Biosciences 通过简化的 NGS 工作流程,基于 SLIMamp™ 和 PiVAT™ 的产品帮助 NGS 实验室和临床肿瘤学实验室提高诊断效率,从而使精准医学触手可及。
上海真固生物科技有限公司由位于上海和波士顿的创始人共同创立,是一家兼具中国文化基因和国际科技背景的精准医疗技术公司,公司致力于以高通量测序文库制备技术及配套的数据分析与解读系统为核心的临床级精准诊断整体解决方案的研发与应用。公司拥有成熟的针对 gDNA、FFPE DNA、 cfDNA 等的高通量测序「一管」文库制备技术和基于 RNA 的融合基因检测技术,大幅降低了检测试剂盒的成本。与试剂配套的易学易用的生物信息学分析软件,可以「一键」完成从原始数据到突变列表注释的全部数据分析流程。同时提供从样本提取到自动化报告的全流程自动化、「一体化」院内 LDT/IVD 整体解决方案。综合技术优势和成本优势的叠加,有效解决了当前高通量基因测序技术在应用推广过程中存在的效率低、准确率低、流程复杂、成本高等障碍,使高通量测序可以在院内实现「一天」级实验流和「两天」级工作流。有效推动了基因检测在肿瘤、遗传病等领域的普及应用与发展。从而实现精准医疗大众化,惠及国人健康。
目前已有500+行业精英加入基因俱乐部
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()




 个人中心
个人中心
 我是园区
我是园区




