2月17日,Travere Therapeutics与CSL Vifor共同宣布,FDA已加速批准sparsentan用于治疗IgA肾病的上市许可申请,sparsentan成为该疾病领域的首个非免疫抑制疗法。

IgA肾病 (IgAN)是一种进行性肾脏疾病,其特征是免疫球蛋白A (IgA) 在肾脏中的积聚。IgA是一种帮助身体抵抗感染的蛋白质,IgA的沉积导致肾脏正常过滤机制与功能的进行性丧失,血液和蛋白质残存在尿液中而形成血尿和蛋白尿。
IgAN是全球最常见的原发性肾小球肾炎类型,也是导致终末期肾病 (ESKD) 的主要原因。IgAN在美国和欧洲属于罕见病,而该疾病在亚洲地区的发病率明显升高,也是我国最常见的肾小球疾病。目前还没有批准用于IgAN的非免疫抑制疗法。
Sparsentan是一种双重内皮素血管紧张素受体拮抗剂 (DEARA),只需每日口服一次。Sparsentan可靶向阻断内皮素A受体和血管紧张素II亚型1受体通路,有利于保护肾小球足细胞,防止肾小球硬化和系膜细胞增生以减少蛋白尿。2022年8月,欧盟也受理了sparsentan用于相同适应症的有条件上市许可申请。预计,欧盟将在2023年下半年作出审批决定。

此项批准主要基于正在进行的III期PROTECT研究的关键中期结果,这是IgAN领域迄今为止规模最大的干预性研究。PROTECT研究达到了具有统计学意义的预先指定的中期主要疗效终点,治疗36周后,接受sparsentan的患者蛋白尿从基线平均减少49.8%,而接受厄贝沙坦治疗的患者蛋白尿从基线平均减少15.1%
(p<0.0001)
。
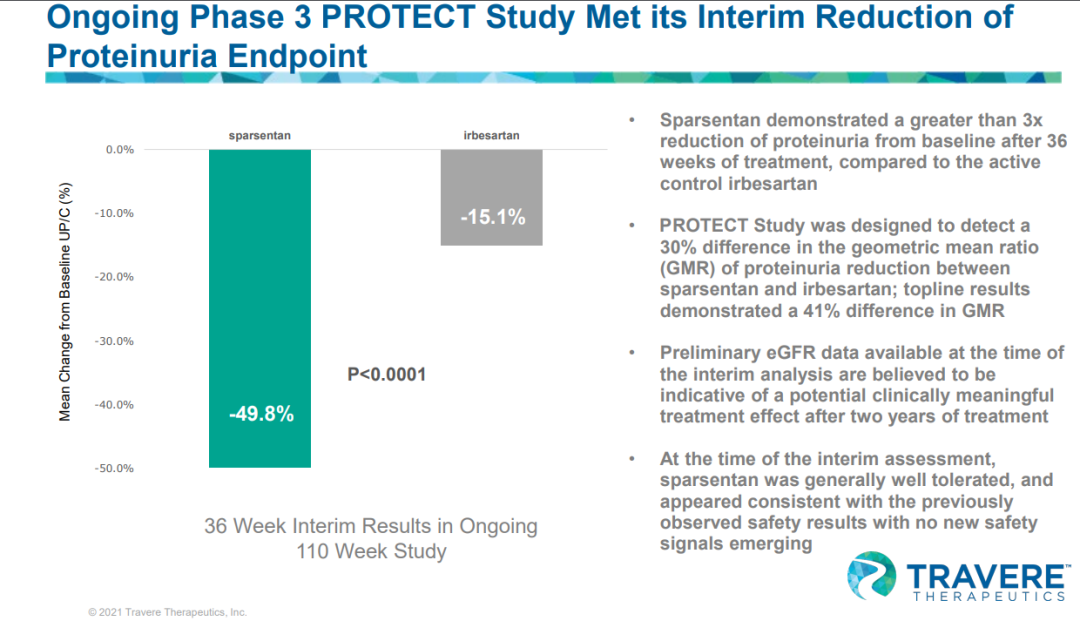
中期评估时的初步结果表明,sparsentan 总体上具有良好的耐受性,并且与其整体观察到的安全性特征一致。
在此次首肯之前,FDA曾要求Travere Therapeutics更改拟议的风险评估缓解策略(REMS),并提出肝脏监测要求,导致sparsentan延期3个月获批。虽然并未观察到sparsentan肝毒性相关的不良反应,但是内皮素受体拮抗剂诱发的肝毒性问题不容小觑,辉瑞的西他生坦曾因此而退市,强生旗下的双重内皮素受体拮抗剂波生坦也会引起严重的肝损伤。
Travere预计,将于今年第4季度公布PROTECT研究中为期两年的确认性终点的关键结果,以支持sparsentan在IgAN中的加速审批转化为常规批准。
Sparsentan目前也在关键的III期DUPLEX研究中进行评估,用于治疗局灶节段性肾小球硬化症(FSGS),这是另一种罕见的进行性肾脏疾病和终末期肾脏疾病的主要原因。
此前,
sparsentan已在欧洲和美国获得孤儿药资格认定,用于治疗IgAN和FSGS。
值得一提的是,sparsentan也出现在科睿唯安发布的《2023年最值得关注的药物预测》中,预计2027年该药物的销售额将达到8.09亿美元。
Sparsentan 的加速批准是我们推进IgA肾病变革性治疗道路上的一个重要里程碑。”
Travere Therapeutics
总裁兼首席执行官
Eric Dube
博士表示:“作为一款first-in-class非免疫抑制疗法,我们相信sparsentan有可能最终成为IgA肾病的新护理标准,为患者带来希望。到目前为止,他们几乎没有治疗选择。”
Copyright © 2023 PHARMCUBE. All Rights Reserved.
欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,并注明公众号名称及ID。
免责申明:本微信文章中的信息仅供一般参考之用,不可直接作为决策内容,医药魔方不对任何主体因使用本文内容而导致的任何损失承担责任。





 药选址
药选址



