慢性伤口,是指在 8-12 周内都无法自行恢复至正常功能的解剖型伤口。据报道,为了治疗由于慢性伤口所带来的并发症,全球每年耗费将近 250 亿美元。
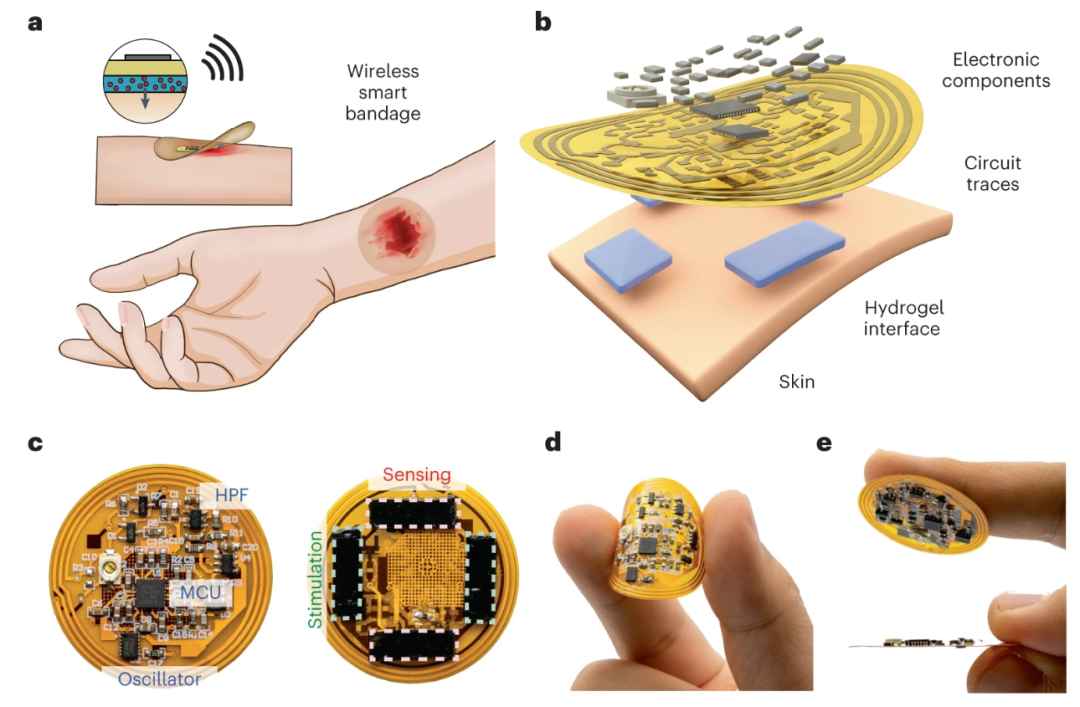



-
如何在有限的尺寸下集成所有需要的电子器件,并且在动物体上保持稳定高效的工作; -
如何让皮肤电极同时兼顾可逆组织粘性、低界面阻抗、高强度、以及高生物相容性; 如何解决基于离子型引发剂的传统水凝胶化学、与基于水分散胶体的导电高分子之间无法相容的问题。
一开始在探索可逆组织粘性时,课题组的思维主要局限在传统的化学方式上,即通过引入断键反应来让粘胶脱离皮肤。
然而,在伤口这一娇嫩体系中,引入额外的化合物溶液会引起巨大的免疫反应,在实际应用中很难实现临床转化。
在这个问题上,该团队摸索了很久。而最终设计的可逆粘性凝胶,是基于聚(N-异丙基丙烯酰胺)骨架的可逆温控相变。实际上,这一思路起源于研究人员和实验室其他成员的随机聊天。
虽然聚(N-异丙基丙烯酰胺)的温控相变,是高分子物理中广为人知的性质。但是,对于其在组织粘性中的表现,之前并没有过报道。
而在本研究中,课题组也只是抱着试一试的心态进行了尝试,尽管相变点并不是体温附近,但是没想到一开始的预实验,就显示了良好的温控粘性。
接着,针对这一现象的背后原理,他们进一步调整了亲水/疏水嵌段的比例,从而实现了理想的工作温度。
论文中,研究人员也展示了这一新型生物电子界面在正常人体体温时(37℃),巨有极大的皮肤粘性,可以保持长期稳定的电极接触。
而在略微提升的温度下(40℃),该凝胶则会完全丧失粘性,可以被轻松得从皮肤上取下,而不会引入任何额外的张力。

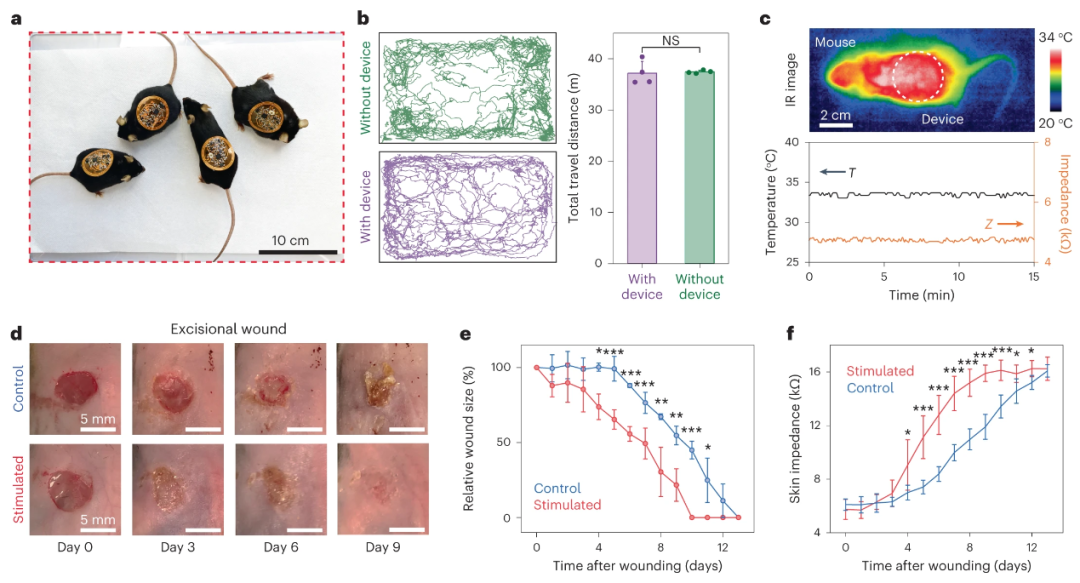
在多个临床前动物模型中(整皮切除、烧伤、糖尿病伤口、细菌感染等),该团队展示了轻薄的智能创可贴可以稳定得附着在小鼠皮肤表面,而不会影响其正常运动。
同时,无线传感器可以持续检测皮肤的生理学状态(阻抗和温度),并且可以控制发送电学刺激信号来促进伤口愈合、新血管形成、和皮肤组织再生。与对照组相比,治疗组愈合速度快约 25%,真皮重塑增强约 50%。
在有伤口感染情况时,阻抗和温度传感器可以在临床上肉眼可见的症状出现前就定量判定感染情况,并且自动开始电击治疗杀菌,以闭环控制方式避免伤口感染后的复杂情况。
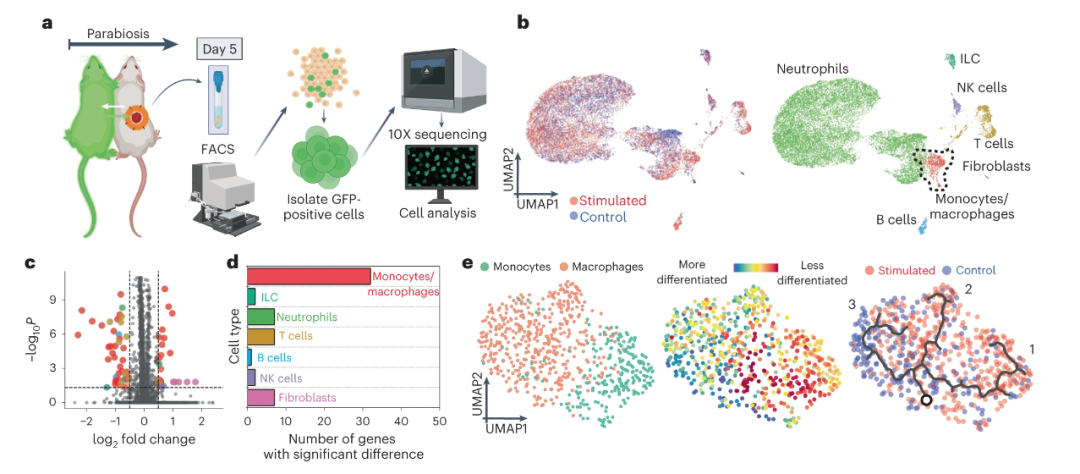
最后,为了理解前面所观察到的伤口加速愈合背后的分子机制,研究人员利用单细胞测序技术对治疗后的伤口组织进行了深入的研究。
值得一提的是,由于智能创可贴的轻薄无线特征,该团队得以使用复杂的连体共生模型来观察电击过程对于以往很难研究的、在血液中循环的免疫细胞的影响。
在分析单细胞测序结果后,课题组发现在所有免疫细胞中,巨噬细胞在电击情况下,有最多种基因出现了统计学显著的表达差异。
在电击治疗组中,研究人员也找到了一系列会促进组织再生的基因的上表达,尤其是关于激活 M2 巨噬细胞的标志物。
通过流式细胞仪和免疫荧光染色,作者进一步在蛋白表达层面确认了电击对 M2 巨噬细胞的激活作用,从而揭示了电击治疗对促进伤口愈合和组织再生的积极作用。
此次工作主要是基于临床前动物模型的研究,为了能在慢性伤口病人上实现真正的临床应用,还需进一步考虑如何降低器件加工成本、材料的长期储存、继续提高生物相容性等问题。
此外,除了论文中使用的阻抗和温度传感器外,研究人员也考虑进一步集成更多的设备来感应伤口的代谢物、生物标志物、pH 等信息,从而在人体上得到多维度的数据集,最终目标是可以结合先进的算法,更准确地评估和预测伤口的愈合情况,并调整治疗方案。
可以说,这一系列工作本身的出发点就是医疗应用,后续课题组也会专注于下一步的临床转化,目标是在慢性伤口病人上取得临床应用级别的进展。
参考资料:
1.Jiang, Y., Trotsyuk, A.A., Niu, S.et al. Wireless, closed-loop, smart bandage with integrated sensors and stimulators for advanced wound care and accelerated healing. Nat Biotechnol (2022). https://doi.org/10.1038/s41587-022-01528-3
由 DeepTech 携手《麻省理工科技评论》重磅推出的《科技之巅:全球突破性技术创新与未来趋势(20 周年珍藏版)》已开启预售!点击下方海报可购买图书!




 个人中心
个人中心
 我是园区
我是园区






