▲点击上方的蓝色“医谷”关注我们

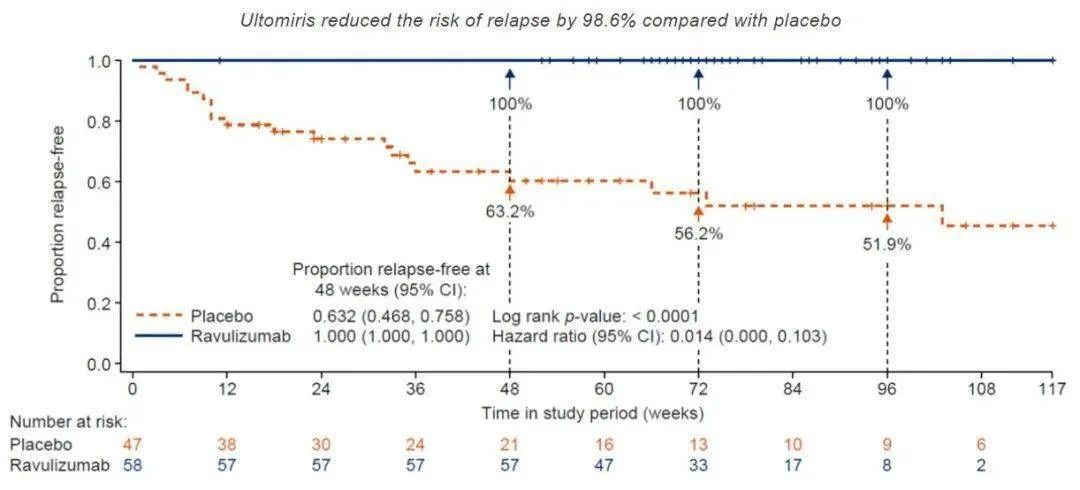
当地时间10月27日,阿斯利康宣布,旗下Alexion公司开发的长效补体C5蛋白抑制剂Ultomiris(ravulizumab)治疗抗水通道蛋白-4(AQP4)抗体阳性(Ab+)视神经脊髓炎(NMOSD)的III期CHAMPION-NMOSD研究达到主要终点,试验结果积极。数据显示与外部安慰剂组相比,Ultomiris能将抗AQP4抗体阳性的NMOSD患者的复发风险降低98.6%。详细数据公布于今年的欧洲多发性硬化治疗与研究委员会大会(ECTRIMS)中。

NMOSD是一种罕见的自身免疫性疾病,患者主要症状为视神经和脊髓出现炎症性病变,可表现为视力问题、剧烈疼痛、膀胱/肠道功能丧失、皮肤感觉异常等,这些症状往往很严重且反复发作,并可能导致永久性残疾。
Ultomiris 是全球首个也是唯一一个获批的长效 C5 补体抑制剂。补体级联反应是免疫系统的一部分,其不受控制的激活可导致免疫反应攻击患者自身的健康组织和细胞,导致不同组织和器官的损伤。补体蛋白C5处于补体级联反应的末端,靶向这一蛋白可以调控所有3种不同通路激活的补体信号,因此抑制C5的活性可以抑制对自身的免疫攻击,从而缓解疾病症状。
2018年Ultomiris获得FDA批准上市,用于阵发性夜间血红蛋白尿症(PNH)成人患者的治疗;2021年6月,FDA扩大该药物的使用范围,涵盖了PNH儿童(1个月及以上)和青少年患者;2022年4月获FDA批准用于治疗抗乙酰胆碱受体 (AChR) 抗体阳性的全身性重症肌无力 (gMG) 成人患者。
此次公布的CHAMPION-NMOSD试验,是一项开放标签、多中心的全球临床3期试验旨在检验Ultomiris在成人NMOSD患者的疗效与安全性。结果显示,与安慰剂相比,在73周的中位治疗持续时间中,Ultomiris将AQP4 Ab+ NMOSD复发风险降低了98.6%(p<0.0001);此外,在第48周时,100%接受Ultomiris治疗的患者保持无复发状态,而外部安慰剂组的这一数据为63%。同时,该试验还达到了多项关键次要终点,包括年复发率和行走能力等。此外,Ultomiris安全性与耐受性良好,与既往研究和实际使用一致,没有观察到新的安全信号。最常见的不良反应为头痛、背痛、关节疼痛等。
值得一提的是,Ultomiris原本由Alexion研发,2020年12月,阿斯利康宣布以390亿美元的现金和股票收购Alexion,该收购已于2021年7月完成,这也是阿斯利康自1999年成立以来的最大金额收购个案,为该公司在罕见病领域的布局打下了重要基础。2020年Ultomiris的全球净销售额为10.77亿美元。
目前,全球已经批准多款补体药物,包括阿斯利康的Soliris和Ultomiris、Apellis的Empaveli、Chem Centryx的Tavneos、赛诺菲的Enjaymo等,其中仅Soliris在国内获批。Soliris同样是Alexion开发的补体C5抑制剂,其自2007年上市以来已获批多项适应症,并成为全球最畅销的罕见病药物之一,其2020年销售额高达40.64亿美元。
文 | 医谷
推荐阅读
《艾滋病基因疗法首例人体试验启动,有望实现“一次治疗、终身治愈”》
 更多关于张江细胞产业园,请点击这里
更多关于张江细胞产业园,请点击这里


寻求广告投放、会议合作、企业传播等请联系400-689-7892。



 个人中心
个人中心
 我是园区
我是园区





