

同时,该论文更深层次的意义在于,如能认识到多巴胺作用的本质,那么将来完全可以绕过多巴胺系统去治疗相关疾病。即我们对事物的理解越清楚,可以干预的手段就越多。基础研究的魅力就在于此。
早在 20 世纪 70 年代,人们就开始研究多巴胺系统,那时就已发现如果刺激胆碱系统(cholinergic system),能够让多巴胺的末梢释放变得特别强。当时,大家以为只是末端调控(terminal regulation)。到 2000 年左右,学界逐渐发现胆碱系统的活动可能会直接诱发多巴胺的释放。
一百多年来,大家其实也见过反向传递的情况。例如,癫痫病人脑内会产生反向传递。脑内还有一些特殊的神经元,如果持续刺激超过 20 分钟,也能逐渐从末梢产生反向传递。不过,这些都是比较极端的情况,所以大家一般认为大部分神经元还是单向传播,而反向传播则可能是一种病态表现。
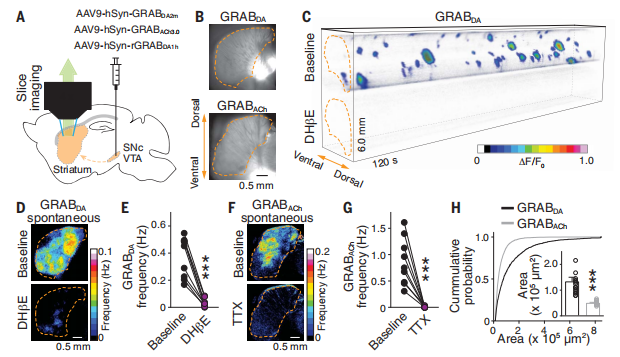
当时,刘长亮也没有特别好的办法去观测自发的乙酰胆碱造成的多巴胺释放,只能用电化学方法,该方法的敏感度还不错,但由于每次只能记录一个点,如果用来观测自发释放(spontaneous release),产生信号的概率很低。刘长亮认为最好可以观测到一个面、甚至一个三维区域,但前提得有相应的技术手段,不然就只能一个点一个点地筛查。2018 年底,北大李毓龙团队开发了一种多巴胺分子探针,当与多巴胺结合之后会变亮3。“这其实非常符合我们的要求,所以我们也借了他们技术的东风,最终观测到了多巴胺自发释放。否则这个过程一定是比现在艰苦十倍。”刘长亮表示。
3 月 24 日,相关论文以《控制多巴胺释放的远端轴突中的动作电位启动机制》(An action potential initiation mechanism in distal axons for the control of dopamine release)为题,发表在 Science4。其中一位审稿人评价称,该成果令人“耳目一新”。


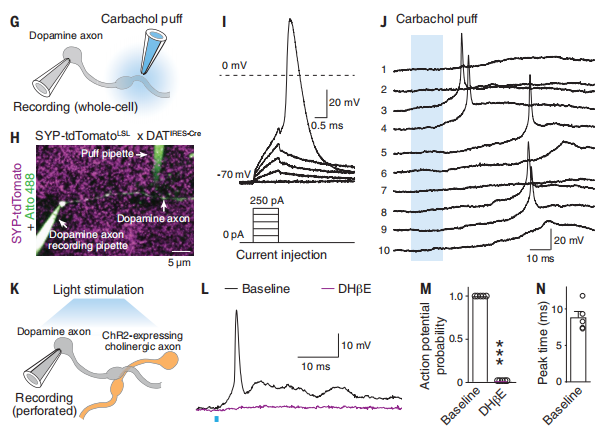
在证明该调控在体存在以后,刘长亮其实已经心里有底:现在只要能把多巴胺轴突上的动作电位记录下来就可以结束研究。为此,刘长亮打造出一种测量神经元群体放电(population firing)的新方法。通过光遗传和碳纤维电极,他记录到微伏级的场电位的波动并用药理学方法证明这是放电波形。其表示:“当时心里就很有底了,唯一的问题是这种信号是群体电活动,不是单个轴突的行为,如果能记录到单根轴突的动作电位(axonal action potential),这项研究就可以完美收官。”神经学领域有一个常规技术叫做膜片钳,它一般用于记录 20 微米左右的神经元胞体,但却很难记录轴突(axon),因为轴突只有 1 微米,这时做记录就好比在非常小的范围里做手术。
不过刘长亮认为,即便到这一阶段,该成果依然属于纯粹的电生理学研究,如果把论文投在 Science 或 Nature 会比较冒险,但是故事已经相当不错。这时他心想,既然该调控在体存在,一般就会有对应的功能。所以他在此基础上,做了一些行为实验。

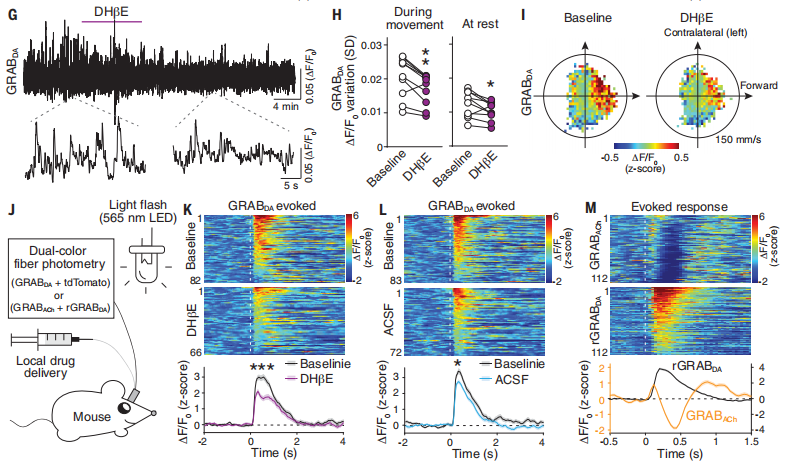
2020 年 3 月,第一批行为实验完成,期间他同步记录了在体多巴胺和乙酰胆碱的波动以及动物的自由运动。后来因为新冠疫情导致所在城市封城,不过刘长亮说:“但这对于我来说,反而是一个好事。分析行为有两种思路,一种是所谓的经典范式,即设计一个系统让动物去按照我的意愿做事情,然后我再去想象动物脑内想了什么事情。另外一种是不去干预动物,它愿意干啥就干啥,但是在分析上下很大功夫。后来,我通过一些人工智能方法来描述动物行为,这样就有望把某一行为模式和所感兴趣的信号配对。”
封城期间,刚好刘长亮在屋里也没事,于是干脆用人工智能的办法去分析动物行为,他把已获取的信号铺在一起,不断地迭代和分析。后来发现,多巴胺的释放与动物移动方向高度相关。“至此这个故事就非常好了,既有扎实的电生理分析,也有行为学研究。迅速截稿,投出,之后就很顺利了,中间基本上只经历了三个月左右。”他说。
对于研究过程,他认为自己运气特别好,正发愁没有某种工具时,好像没隔多久就会有人发明相关技术。他说:“运气特别好的是,我朋友圈正好有人认识相关的研究者。我感觉从来没有做过这么顺利的研究。当然挫折肯定有,做科学研究都是失败居多,已经习惯了。”

在未来计划上,一方面刘长亮正在继续研究动作电位在末梢起步之后的情况,比如是否能回传到胞体。多巴胺神经元比较特别,除了能够在末梢释放,在胞体和树突上也能释放。最近大家意识到这种释放与帕金森疾病的联系密切,这就相当于是双向调控,在胞体产生的动作电位传递到末梢释放,而在末梢上产生的动作电位也有可能传递到胞体在胞体上释放,因此这是一个矛盾,也是有待他去研究的对象。
长远来看,现在只是“蜻蜓点水”地证明了该调控可能产生的作用,但是多巴胺系统到底怎么发挥作用仍不清楚。具体研究步骤上,他当然会从运动入手,运动相对简单一点,因为它是一个客观描述。但是,多巴胺系统往往跟学习记忆和奖赏系统,例如毒品成瘾等心理认知层面的东西相关,所以这也是刘长亮接下来要涉及的研究领域。
据悉,该团队由哈佛大学帕斯卡尔·凯泽(Pascal Kaeser )领导(其导师是 2013 年诺奖得主托马斯·C·苏德霍夫)。该课题组主要研究神经传导的基本原理。神经元之间靠突触联系,这是一个计算的基本单元,突触传递的基本过程如下:神经递质被包裹在一些囊泡里,当动作电位到来,一套蛋白组件将囊泡推到膜外,两个膜融合到一起,然后神经递质就会释放。
刘长亮博士阶段做的是在体多巴胺神经元编码,对分子的研究较少,于是就加入了该实验室,学习分子生物技术并开发了多种先进电生理和成像方法系统研究多巴胺的释放机制。正好,其导师对没有突触结构的释放很感兴趣。当然,起初的研究很困难,他表示甚至自己连碳纤维都不会制作,当时他把美国市面上比较好的碳纤维试了个遍,结果效果都不好。后来,他逐渐攻克相关技术,期间也得到了合作者的鼎力支持。其表示:“好在我们经费充足,可以去试错,但是最重要的还是项目本身是否值得耗费那么多时间。”

1. Threlfell, S. et al. Striatal Dopamine Release Is Triggered by Synchronized Activity in Cholinergic Interneurons. Neuron 75, (2012).
2. Liu, C., Kershberg, L., Wang, J., Schneeberger, S. & Kaeser, P. S. Dopamine Secretion Is Mediated by Sparse Active Zone-like Release Sites. Cell 172, (2018).
3. Sun, F. et al. A Genetically Encoded Fluorescent Sensor Enables Rapid and Specific Detection of Dopamine in Flies, Fish, and Mice. Cell 174, 481-496.e19 (2018).
4. Liu, C. et al. An action potential initiation mechanism in distal axons for the control of dopamine release. Science 375, 1378–1385 (2022).




 个人中心
个人中心
 我是园区
我是园区




