
从2001年首次发表至今,历经20余年的发展与沉淀,PROTAC靶向蛋白降解技术的黄金时代已然来临。
2022年1月18日,PROTAC技术的发明人之一,这一革命性领域持续的开拓者、最重要的贡献者——耶鲁大学的Craig Crews教授发表了有关PROTAC技术的最新综述:PROTAC targeted protein degraders: the past is prologue,并在其中分析预测未来20年PROTAC技术4大爆发机会点。

1. 序曲的开端:“泛素蛋白”的发现
早在1942年,Schoenheimer通过同位素技术发现蛋白是处于一面被持续地合成出来一面被持续地降解掉这样一个动态平衡中。蛋白是如何被降解的成为了生物学界持续近半个世纪的研究主题。
在1975年,Goldstein首次从牛胸腺中发现了一种只有76个氨基酸的小蛋白。后来发现这个蛋白质广泛地存在于各种组织和有机体中。这个蛋白因其存在之广泛(ubiquitous)而被命名为泛素蛋白(Ubiquitine)。
在随后的70s-90s年代,泛素蛋白被发现在蛋白降解中起到了重要的作用。在此期间一系列突破性的发现建立了蛋白降解的主要机制:泛素蛋白-蛋白酶体系统。
在E1,E2,E3连接酶的作用下,多个泛素蛋白被转移到一个需要被降解的蛋白上。被贴上泛素蛋白标签的目标蛋白进而被蛋白酶体识别,并在蛋白酶体空腔内被降解成多肽片段和氨基酸分子。Aaron Ciechanover, Avram Hershko和 Irwin Rose因发现泛素蛋白介导的蛋白降解而获得2004年Nobel化学奖。

图片摘自诺奖官网
在2001年Craig Crews教授及合作者在PNAS上发表了一篇突破性文章。作者们首次提出一个崭新的概念:PROTAC(靶向蛋白酶解嵌合体分子)。如下图所示,PROTAC分子由三部分组成:靶点蛋白配体,E3连接酶配体,还有链接部分将二者连在一起。
PROTAC分子一端和靶点蛋白相结合,另一端和E3连接酶结合,从而将靶点蛋白和E3连接酶强拉到一起。这样就促进E3连接酶催化泛素蛋白转移到靶点蛋白上。被泛素化的靶点蛋白就能被蛋白酶体识别并降解。靶点蛋白承担的生理功能将随着靶点蛋白的消亡而消失。通过降解靶点蛋白而调控其生理功能开辟了一条前所未有的生物医药研究和制药新途径。
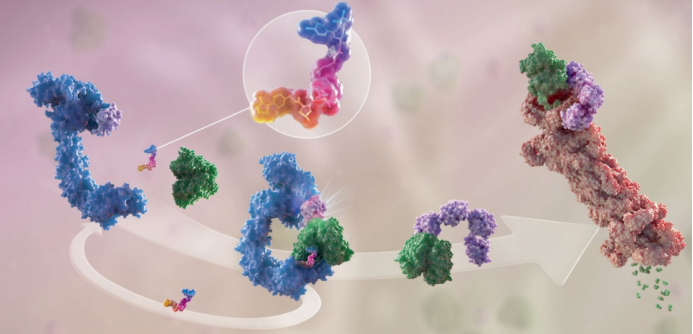
图片摘自:Bekes, M.; Langley, D. R.; Crews, C. M. PROTAC targeted protein degraders: the past is prologue. Nat. Rev. Drug Discov. 2022, ahead of print.
尽管设想创意满满,但是现实很骨感。PROTAC的概念提出伊始便遭遇重重困难,饱受质疑。尽管靶点蛋白不乏小分子配体,但是E3连接酶的配体研究却近乎空白。在2001年的这篇PNAS文章中,作者们使用了一个多肽作为E3连接酶的配体。基于多肽的PROTAC分子无法透过细胞膜,缺乏实际应用的潜力。
虽然可以通过微注射的技术把多肽类PROTAC化合物送入细胞开展研究,但实用价值几近于无。在2001年之后的十来年内,跟进这个领域的工作屈指可数。
在2008年,Crews课题组发表了靶向雄激素受体(AR)的基于小分子E3连接酶配体的PROTAC。这个工作标志着PROTAC领域的一个突破:基于小分子配体的PROTAC使得改善成药性成为可能。但是困难依然存在:由于三组分的设计,PROTAC分子的分子量通常较大(~1000),违反业界所接受的成药性规律如成药性五之原则,属于传统意义上不能成药的分子空间,渗透性,口服PK极具挑战性。
图片摘自:Churcher, I. J. Med. Chem. 2018, 61, 444.
在20年后的今天,PROTAC技术已经成为小分子药物研发的热点领域。传统小分子药物抑制剂的活性是占位驱动。而PROTAC化合物的活性由于这样一个全新的降解机理,是事件驱动。
一旦靶点蛋白降解完成,PROTAC分子又可以周而复;始地进入降解靶点蛋白的循环。相对于传统小分子药物和生物大分子药物,PROTAC药物可以兼二者之长免二者之短,会有这样的潜在特性:高活性,高选择性,可以口服,全身系统性分布,类似催化剂的作用,可能只需要较低的临床剂量。
设计PROTAC化合物不需要靶点蛋白的抑制剂,只需要能够和靶点蛋白结合的配体。由于链接部分也会参与形成三元复合物、贡献结合能,和靶点蛋白结合较弱地配体也有可能形成降解活性很高的PROTAC分子。这一系列特性使得PROTAC有可能靶向那些“不可成药靶点”,完成以前传统小分子药物无法完成的任务。
在2013年Crews教授成立了专注于开发PROTAC靶向蛋白降解技术的Arvinas公司。学界和工业界的合力促进了这个技术和PROTAC药物的快速发展。Arvinas开发的靶向AR和ER的口服PROTAC药物已经在临床上达成了口服PK,安全性,初步药效的概念验证。
Arvinas在2018年挟临床前阶段的PROTAC产品管线就成功上市充分显示了资本界对这一革命性创新技术的认可和期待。在IPO近4年后的今天,Arvinas公司市值已暴涨7倍。紧随Arvinas,专注于蛋白降解技术的初创公司Kymera,C4,Nurix等都是以临床前的产品管线就成功上市。各大药企也竞相布局靶向蛋白降解领域,纷纷和这些初创公司合作。
最近的一个合作是2021年7月美国医药巨头辉瑞公司和Arvinas达成共同开发ER降解剂ARV-471的协议:辉瑞将支付高达24亿美元的头款、股权投资和里程碑付款,双方共同开发ARV-471并平分未来的销售收入。
迄今拥有临床阶段PROTAC产品管线的公司及产品管线如下表所示。
虽然Arvinas仍然是PROTAC领域的领头羊,但是中国的药企正在迎头赶上。尤其是在更具挑战性的口服PROTAC产品管线上已有三家中国药企杀入竞争的前沿,跻身口服PROTAC领域的第一梯队。老牌上市药企海思科和创新药物龙头企业百济神州不约而同地布局了BTK PROTAC。而专注于肿瘤尤其是前列腺癌以及代谢类疾病的Bio-tech企业海创药业异军突起,基于其在前列腺癌领域的深度布局而开发了AR PROTAC。
在前列腺癌领域,靶向难以成药的AR剪切突变体以治疗耐药性前列腺癌,一直是未满足的临床需求,其攻克极具挑战性。Arvinas已向这个目标努力多年。海创药业迎难而上也在开展这个方向的PROTAC研究。且看最后谁能在这个方向取得突破。
从黄金时代出发,走向更深广的未来:PROTAC临床转化爆发点预测
PROTAC领域的挑战性依然存在,但是随着ARV-110,ARV-471,KT-474等一系列化合物的临床数据的披露,PROTAC这一革命性治疗手段已经得到了在人体上的概念验证(Proof of concept):口服PK是可以达到的,PROTAC化合物可以是安全的,靶向蛋白降解和初步药效是可以达到的。留给研究者的问题更多的是如何发现更好的PROTAC分子。
经过近20年的积累,人们对PROTAC化合物的分子设计,构效关系,口服PK等都有了更深刻的理解。新的技术如计算化学,AI助力的药物发现,DEL化合物库都可能加速PROTAC药物的发现和开发。随着这些PROTAC临床产品管线的不断推进,临床优势的不断凸显,PROTAC技术势必迎来一个蓬勃发展的新时代。
让我们回到Crews教授的这篇综述。PROTAC技术在接下来的20年里将会如何发展?Crews教授在这篇综述指出了4个临床转化的爆发点:
●
在临床上验证分子胶和PROTAC之外的靶向蛋白降解模式。
目前进入临床的蛋白降解药物主要是靶向于已经验证过的成熟靶点。这一策略可以验证蛋白降解技术作为一种新的治疗模式可以通过降解靶点蛋白发现“同类最佳“的药物。但是蛋白降解技术更大的价值在于靶向那些难成药靶点,甚至是那些尚未触及的新靶点。
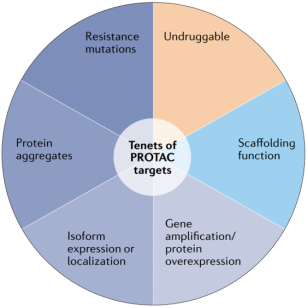
图片摘自:Bekes, M.; Langley, D. R.; Crews, C. M. PROTAC targeted protein degraders: the past is prologue. Nat. Rev. Drug Discov. 2022, ahead of print.
PROTAC只需要和靶点蛋白有结合作用,而不一定要结合在活性位点。因此PROTAC可以比传统的抑制剂有更多的靶点选择。更适用于PROTAC蛋白降解技术的靶点包括:偏离正常状态的蛋白,如过表达,基因突变,聚集,以及表达/分布偏差产生获得性功能的致病蛋白。
还有那些进化出耐药突变的蛋白,具有骨架功能的蛋白,以及现有手段无法靶向的难成药蛋白都适用于PROTAC蛋白降解技术。PROTAC的靶点蛋白需要在蛋白表面有一个E3连接酶可以接近的结合位点,并且有一个无结构区域可以被牵引进入蛋白酶体进行降解。
人体有近600种E3连接酶可供探索,但目前进入临床的PROTAC化合物只利用了CRBN和VHL两种E3连接酶。问题不在于“是否”能有基于新的E3连接酶的蛋白降解药物进入临床,而是“何时”和治疗“何种疾病”。尽管现有的CRBN和VHL E3连接酶已经成功地被应用于靶向蛋白降解技术,开发新的E3连接酶还是很有必要。尤其是在肿瘤领域,一个新的药物应用后很快就可能产生耐药性。
如果仅仅依赖于现有的两三种E3连接酶来开发蛋白降解药物,就有理由担心肿瘤突变产生针对这几种E3连接酶的耐药性。
那么何处去寻找新的连接酶,何种连接酶适用于开发PROTAC药物呢?一种比较实际的途径是跟进那些更类似于CRBN和VHL,广泛存在又广泛适用的连接酶。这样的连接酶可以没有限制地和所选择的靶点蛋白匹配,又可以适用于不同的疾病领域。
不同的连接酶可能导致不同的降解活性。而这种差异可以归因于几个方面:靶点蛋白和连接酶形状的匹配度,连接酶和靶点蛋白形成有降解能力的三元复合物的能力,在亚细胞层面靶点蛋白合的位置和连接酶的位置相匹配的差异,靶点蛋白和连接酶在特定类型细胞中的表达程度。
近来横空出世的源自Google/DeepMind和RoseTTAFold的AI驱动的三元复合物结构预测模型将助力针对尚未触及的靶点和连接酶的计算机辅助药物发现。
组织和细胞特异性的连接酶可以提供开发具有针对性的蛋白降解药物的机会。学术界和工业界都对发现具有独特蛋白表达特性的连接酶有浓厚的兴趣。这样可以引发组织特异性和细胞特异性的精准靶向蛋白降解(pTPD)-蛋白降解领域最令人兴奋的课题之一。特异性高表达的连接酶可以用来降解靶点蛋白,实现药效。而特异性低表达的连接酶则可以用于降低毒性,提高安全性。
在疾病组织和细胞中富集的连接酶是另一个精准靶向蛋白降解的研究前沿。很多时候肿瘤组织对一种连接酶的富集同时对这种连接酶产生依赖。这种关系可以通过分析不同肿瘤细胞中E3连接酶的CERES得分而得到。这些连接酶的优势在于肿瘤细胞会更难于产生针对连接酶的耐药性。不过这类的连接酶可能不一定会有安全性上的优势。
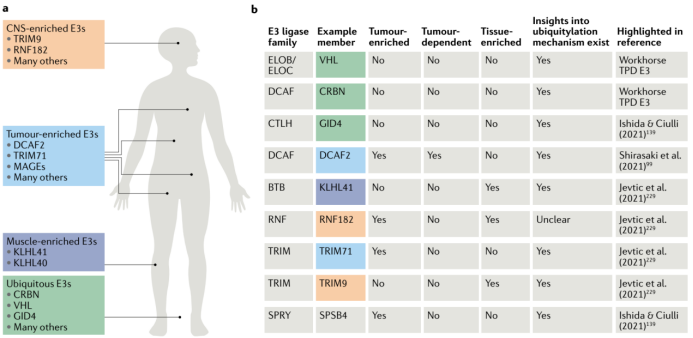
虽然目前上市的IMiD分子胶类蛋白降解剂和临床阶段的PROTAC类蛋白降解剂都集中于肿瘤领域,既然蛋白降解剂有可能降解任何选定的靶点蛋白,靶向蛋白降解的治疗领域正在超越肿瘤领域。
炎症,免疫和免疫肿瘤是一个方向。例如Nurix的BTK降解剂和Kymera的IRAK4降解剂还可能治疗免疫-炎症疾病,例如类风湿关节炎。紧随免疫疗法的步伐,小分子介导的通过激活免疫应答来治疗肿瘤是新药研发的重点领域。PROTAC有可能通过降解PD-1/PD-L1而成为免疫肿瘤领域靶向免疫细胞活化的first-in-class小分子药物。
神经学和神经退行性病变是另一个可能拓展的疾病领域。一些神经退行性疾病涉及某些蛋白的积累而产生的毒性。这样的蛋白包括Tau,α-synuclein, huntingtin (mHTT)突变体,TAR RNA结合蛋白 (TARDBP, 或称TDP43) 还有FUS RNAbindi(FUS)。
PROTAC化合物可以应用其降解蛋白的功能清除这些致病蛋白。Tau蛋白病变是一个小分子抑制剂失败而PROTAC可能成功的疾病案例。现在更有待回答的病理学问题不是能否降解Tau蛋白,而是降解Tau蛋白是否能治疗老年痴呆(AD),还有降解Tau蛋白时是否需要顾及其寡聚状态。
应用PROTAC抗病毒也是另一个可以拓展的疾病领域。至少有20多种病毒被发现劫持人体的泛素蛋白-蛋白酶体系统来促进病毒的生存和自我复制。这个现象曾经激发了靶向蛋白降解概念的产生。现在是时候形成一个闭环,把靶向蛋白降解回馈到病毒上去。抗病毒PROTAC的可行性最早是在降解丙肝病毒(HCV)的NS3/4A蛋白中得到证实。
目前针对新冠病毒的PROTAC正在紧密研究中。小分子抗病毒药物的靶点蛋白,如Mpro,PLpro和Rdrp也是抗病毒PROTAC的可能靶点。正在进行临床试验的小分子新冠药物为抗新冠PROTAC提供了出发点。Nurix也公布了有三款靶向新冠的降解剂正在研究中。
PROTAC分子结构设计的思路激发了多种另类PROTAC模式的产生。作者把PROTAC定义为三类:PROTAC应用传统小分子配体,bioPROTAC应用多肽配体,hybridPROTAC应用肽-小分子的杂化弹头。由靶向泛素蛋白-蛋白酶体的PROTAC衍生出了靶向自噬体的AUTAC,自噬体牵引的ATTAC,靶向溶酶体的LYTAC,基于抗体的AbTAC等多种新的蛋白降解模式。
BioPROTAC除了应用多肽之外,还应用融合蛋白,寡核苷酸作为靶点蛋白的配体。这类bioPROTAC有潜力成为新的治疗模式,同时其投送和给药还有困难有待解决。这些另类PROTAC的特性被总结在下表中。
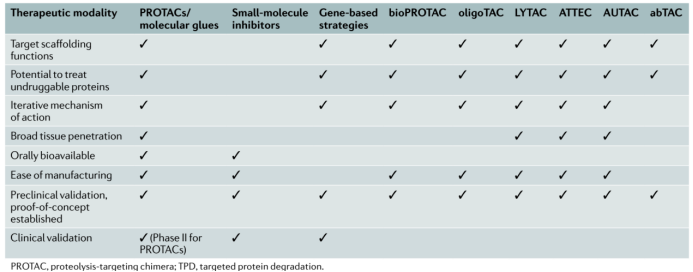
二十年弹指一挥间,PROTAC由2001年的一个充满创意但困难重重的概念到现在多个化合物进入临床开发,从饱受质疑到现在小分子药物研发的热点前沿,从一个学术课题组的寂寞前行到现在多家上市公司的多方赛跑,Crews教授对靶向蛋白降解领域做出了巨大贡献。
现在PROTAC靶向蛋白降解技术已经在临床上完成了概念验证,各种衍生的蛋白降解技术纷纷出现,在生物医药领域的应用潜力不断地被挖掘出来。首批进入临床的PROTAC药物通过靶向成熟靶点验证了PROTAC的概念和并具备了成为“best-in-class”药物的潜力。
在未来的20年里,PROTAC技术有望在难成药靶点和全新靶点上实现“first-in-class”的突破。The past is prologue.未来的20年必然是PROTAC技术蓬勃发展,成果爆发的20年。我们拭目以待国内的药企如何抓住机会,大胆布局,加力耕耘,去成就世界领先的靶向蛋白降解药物,服务世界的患者。

 识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。















 识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!





 个人中心
个人中心
 我是园区
我是园区





