Aurinia Pharmaceuticals公司日前宣布,美国FDA已批准Lupkynistm(voclosporin)上市,与背景免疫抑制疗法联用,治疗活动性狼疮性肾炎(LN)成人患者。新闻稿指出,Lupkynistm是FDA批准的首个LN口服疗法。这也是美国FDA去年12月底批准Benlysta(belimumab)之后不到两个月批准的第二款狼疮性肾炎新药。

狼疮性肾炎是自身免疫性疾病系统性红斑狼疮(SLE)最严重、最常见的并发症之一。患者的肾脏损伤导致蛋白尿和/或血尿的发生,以及肾功能下降和血清中肌酐水平上升。它引起不可逆的肾脏损害,显著增加肾衰竭、心脏事件和死亡的风险。
Lupkynistm是一种潜在“best-in-class”的新型钙调磷酸酶抑制剂(CNI)。它通过抑制钙调磷酸酶,阻断IL-2表达和T细胞介导的免疫反应,稳定肾脏足细胞(podocyte)。与传统的CNI相比,它显示出更可预测的药代动力学和药效学关系。
▲Lupkynistm分子结构式(图片来源:Ed (Edgar181) / Public domain)
Lupkynistm的批准得到了全球性临床试验数据的支持,其中包括两项关键性临床研究——3期临床试验AURORA和2期临床试验AURA-LV。包含357名LN患者的关键性3期临床试验结果表明,Lupkynistm达到40.8%的完全肾脏缓解率(complete renal response rate),对照组这一数值为22.5%(p<0.001)。同时,Lupkynistm达到所有次要终点,并且在预先认定亚组分析中也表现出优异的疗效。
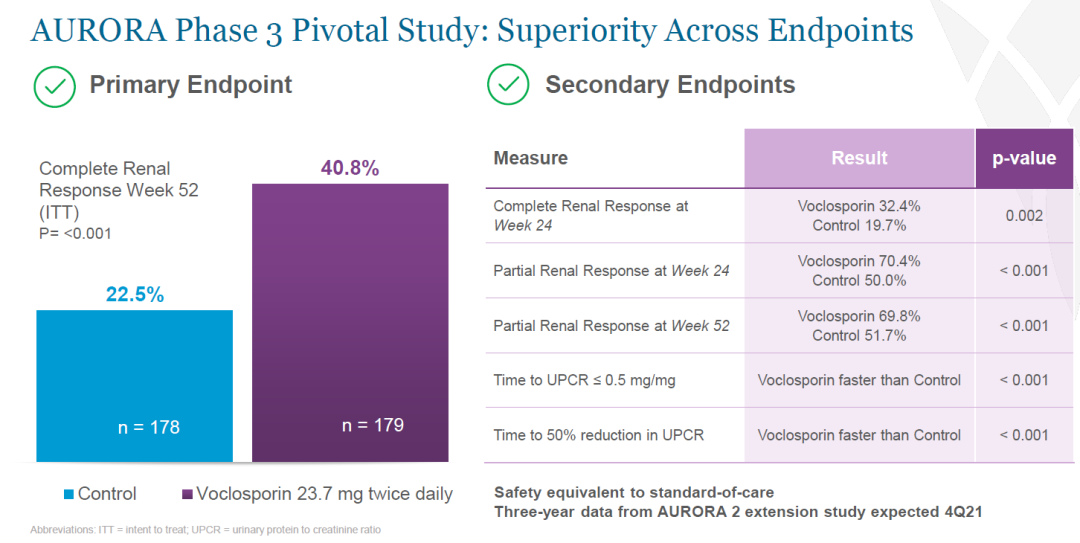
▲Lupkynistm在关键性3期临床试验中达到主要和次要终点(图片来源:参考资料[2])
近日,罗氏(Roche)宣布,其双特异性抗体faricimab在治疗新生血管性年龄相关性黄斑变性(nAMD)患者的两项全球性3期临床试验TENAYA和LUCERNE获得积极的顶线结果。Faricimab是一款同时靶向VEGF-A和血管生成素-2(Ang-2)的双特异性抗体。

nAMD影响全球约2000万人,是60岁及以上人群致盲的主要原因。目前的标准治疗是注射抑制血管内皮生长因子(VEGF)的药物,可显著降低nAMD导致的视力丧失。然而,VEGF并不是致使疾病发生和发展的唯一因素。而且接受抗VEGF单药治疗的nAMD患者通常需要每月到眼科医生那里接受眼部注射。新闻稿指出,faricimab是首个针对眼睛设计的在研双特异性抗体。它靶向Ang-2和VEGF-A两个不同的通路,Ang-2和VEGF-A通过破坏血管的稳定性导致新的渗漏血管形成并增加炎症,从而影响视力。通过阻断这两种通路,faricimab旨在稳定血管,可能为患有视网膜疾病的人带来更好的长期视力结果。
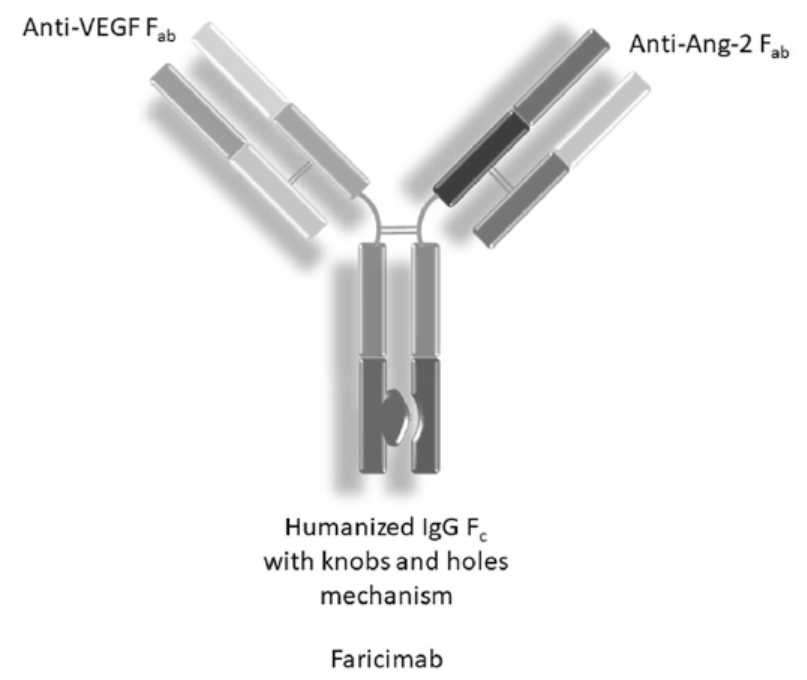
▲Faricimab结构示意图(图片来源:罗氏官网)
TENAYA和LUCERNE是两项相同的随机双盲、全球3期临床研究,在1329例nAMD患者中评估faricimab与VEGF抑制剂活性对照相比的疗效和安全性。研究的主要终点是从基线到第48周,最佳矫正视力(BCVA)评分的平均变化。两项研究均达到了其主要终点,接受faricimab治疗患者的视力结果与活性对照组(每8周一次注射)相比达到非劣效性标准。两项研究中近一半(45%)的患者在第一年每16周接受一次faricimab治疗,这是首次治疗nAMD的眼部注射药物在3期临床试验中达到这么长的持久性。
艾伯维(AbbVie)近日宣布,欧盟委员会(EC)已批准其JAK抑制剂Rinvoq(upadacitinib)扩展适应症,用于治疗成人活动性银屑病关节炎(PsA)患者。这些患者对一种或多种改变疾病进程的类风湿关节炎疗法(DMARDs)不耐受或应答不足。Rinvoq可作为单药疗法或与甲氨蝶呤联合治疗。Rinvoq还获批用于治疗常规疗法效果不佳的成人活动性强直性脊柱炎(AS)患者。这是这款JAK抑制剂首次获批治疗这两类患者群体。

银屑病关节炎是一种全身性炎症性疾病,症状表现在身体多个部位。银屑病关节炎患者的免疫系统产生炎症,可导致与银屑病相关的皮肤病变、关节疼痛、疲劳和僵硬。强直性脊柱炎是一种主要累及脊柱的慢性、炎症性肌肉骨骼疾病,以疼痛、活动受限和结构损伤等衰弱症状为特征。尽管治疗这两种疾病的疗法取得了进展,但是仍然有很多患者的症状没有得到足够的缓解。
Rinvoq是一款每日口服一次的JAK1选择性小分子抑制剂。此前,FDA已批准其上市,用于治疗中重度活动性风湿性关节炎成年患者。此外,它还在其它多个炎症性适应症中进行临床研究,包括克罗恩病、溃疡性结肠炎,以及特应性皮炎。

这两项批准得到3项临床试验结果的支持。在SELECT-PsA1和SELECT-PsA2两项3期临床试验中,Rinvoq在DMARD疗效不佳的活动性银屑病关节炎成人患者中达到了主要终点。即与安慰剂相比,第12周时ACR20应答显著改善。与常见疗法阿达木单抗相比,Rinvoq也达到了非劣效性标准。与安慰剂组相比,接受Rinvoq治疗患者在身体功能和皮肤症状方面也出现更大改善。
在2/3期临床试验SELECT-AXIS1中,Rinvoq用于治疗未接受过生物制品DMARD治疗的成人强直性脊柱炎患者。试验结果表明,Rinvoq达到了主要终点,与安慰剂相比,患者的脊柱关节炎国际协会(ASAS)40应答评估显著改善。
近日,阿斯利康(AstraZeneca)和第一三共(Daiichi Sankyo) 在世界肺癌大会(WCLC)2020上,公布了双方合作开发的两款抗体偶联药物(ADC)datopotamab deruxtecan(DS-1062)和Enhertu在治疗晚期或转移性非小细胞肺癌(NSCLC)患者时的积极结果。Datopotamab deruxtecan是一款靶向TROP2的在研ADC,而Enhertu是已经获批,靶向HER2的ADC。

肺癌是癌症死亡的主要原因之一,约占全球所有癌症死亡的五分之一。80-85%的肺癌属于NSCLC。目前,尚无靶向TROP2或HER2的疗法获批用于治疗NSCLC。
靶向TROP2的抗体偶联药物试验结果
TROP2是一种跨膜糖蛋白,在许多癌症类型中过度表达。TROP2的高度表达与几种实体瘤的总生存期和无病生存期较差相关。NSCLC患者中,在高达64%的腺癌和高达75%的鳞状细胞癌中观察到TROP2表达。
Datopotamab deruxtecan是利用第一三共公司的DXd抗体偶联技术平台设计的潜在“best-in-class”抗体偶联药物,它使用一种可以在肿瘤附近被选择性切割的四肽链接子将靶向TROP2的单克隆抗体与一种拓扑异构酶抑制剂连接在一起。
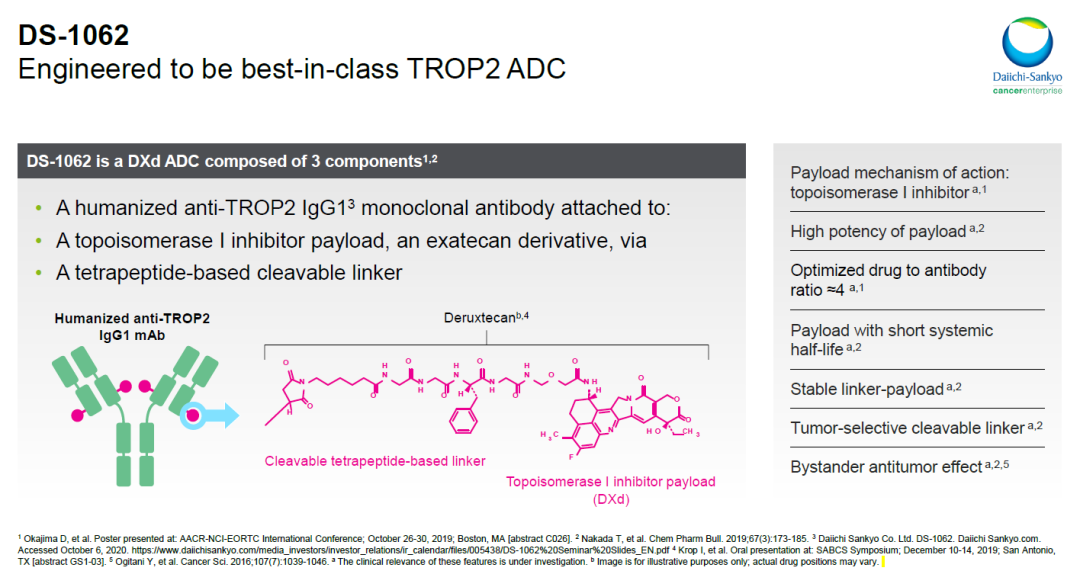
▲Datopotamab deruxtecan(DS-1062)简介(图片来源:参考资料[7])
在名为TROPION-PanTumor01的1期临床试验中,总计159名晚期或转移性NSCLC患者接受了不同剂量的datopotamab deruxtecan (4 mg/kg, 6 mg/kg或8 mg/kg)的治疗。这些患者曾经接受过3种以上的前期治疗,包括含铂化疗(94%)或免疫疗法(84%)。在中位随访时间为7.4个月时,由独立审评委员会确定的客观缓解率(ORR)在21%~25%之间,疾病控制率在67%~80%之间,中位无进展生存期在4.3个月和8.2个月之间。
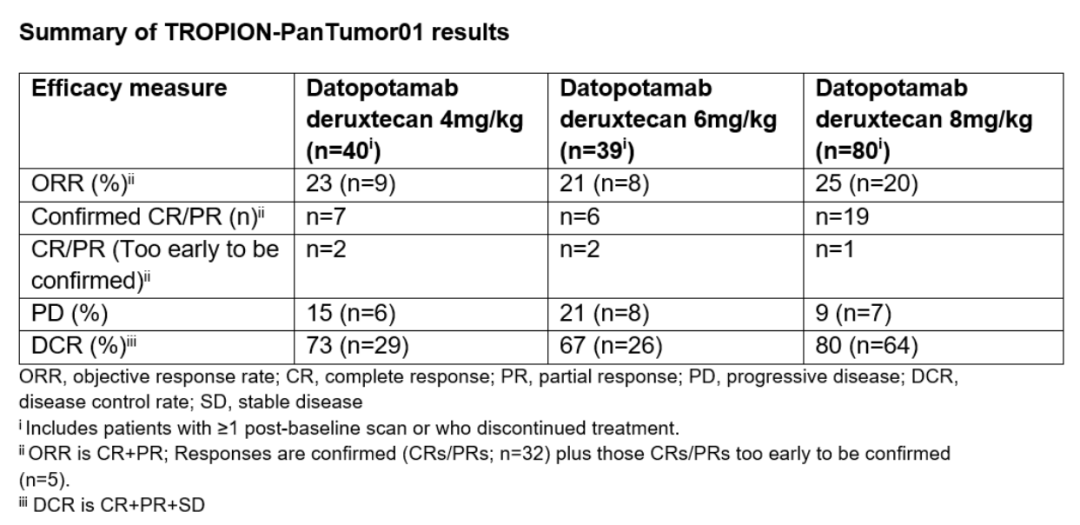
▲Datopotamab deruxtecan的1期临床试验疗效数据(图片来源:参考资料[6])
根据已有的疗效和安全性结果,阿斯利康和第一三共将启动注册性3期临床试验检验datopotamab deruxtecan治疗NSCLC患者的疗效。
Enhertu的2期临床试验结果
在名为DESTINY-Lung01的2期临床试验中,高度表达HER2的转移性NSCLC患者接受了Enhertu的治疗。这些患者平均接受过3种前期治疗,其中包括含铂化疗(91.8%)或免疫疗法(73.5%)。在中位随访时间为6.1个月时,Enhertu达到24.5%的ORR和69.4%的疾病控制率。中位无进展生存期为5.4个月。
近日,礼来(Eli Lilly and Company),Vir Biotechnology和葛兰素史克(GSK)联合宣布,它们达成一项合作,在低风险的轻中度COVID-19患者中评估两种中和抗体疗法的组合。礼来已经扩展其正在进行的BLAZE-4试验,以评估bamlanivimab(LY-CoV555)与VIR-7831(也称为GSK4182136)构成的组合疗法的效果。新闻稿指出,这一独特的合作标志着首次将来自不同公司的中和抗体组合到一起,探索潜在的治疗结果。

Bamlanivimab是一种直接靶向新冠病毒刺突蛋白的中和抗体,旨在阻断病毒附着并进入人体细胞。Bamlanivimab由礼来和AbCellera合作开发,已经获得FDA紧急使用授权(EUA),用于治疗轻度至中度COVID-19患者,这些患者有进展至重度COVID-19和/或住院的高风险。
VIR-7831是一种具有双重作用机制的单克隆抗体。在临床前试验中,该抗体通过与SARS-CoV-1共享的新冠病毒上的一个表位结合,显示出中和新冠病毒的能力。该表位高度保守,这可能使逃逸突变体更难产生。而且对抗体的Fc端的修饰不但让它能够阻断病毒进入健康细胞,还能够激活免疫系统,具有清除受到感染的细胞的潜力。

药明康德内容团队制图
近日,安进(Amgen)公司公布了其在研KRAS G12C抑制剂sotorasib(AMG 510),在包含126例携带KRAS G12C突变的晚期非小细胞肺癌(NSCLC)患者的关键性2期临床试验中获得的最新结果。这是该公司首次公布这一临床试验在随访时间超过一年时的疗效结果。

NSCLC占所有肺癌的80%-85%,大多数患者(66%)在初次诊断时为晚期或转移性疾病。KRAS G12C是NSCLC中最常见的驱动突变之一。一线治疗失败的KRAS G12C突变NSCLC患者的选择有限,目前治疗的结局并不理想。这些患者二线治疗的缓解率约为9-18%,中位无进展生存期约为4个月。
安进开发的sotorasib是首个进入临床开发阶段的KRAS G12C抑制剂,目前正在广泛的临床项目中进行研究,在短短两年多的时间里,sotorasib临床项目也建立了深厚的临床数据集,已经在13种肿瘤类型的研究中用于治疗超过600名患者。它曾经获得美国FDA授予的突破性疗法认定,安进公司已经在去年年底向美国FDA递交了sotorasib的新药申请(NDA)。
▲Sotorasib分子结构式(图片来源:User:Edgar181, Public domain, via Wikimedia Commons)
在名为CodeBreaK 100的关键性2期临床试验中,携带KRAS G12C突变的晚期非小细胞肺癌患者接受了每日一次,剂量为960 mg的sotorasib口服治疗。这些患者中81%曾经接受过含铂化疗和PD-1/PD-L1抑制剂治疗后疾病继续进展。
试验结果显示,在中位随访时间为12.2个月时,sotorasib达到37.1%的确认客观缓解率(ORR)和80.6%的疾病控制率,其中包括3例完全缓解和43例部分缓解。中位缓解持续时间为10个月,中位无进展生存期为6.8个月。
注:本文旨在介绍医药健康研究,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:




 个人中心
个人中心
 我是园区
我是园区




