CRISPR-Cas9技术在疾病治疗领域已经展现出了独特优势,然而体内较低的递送效率以及缺乏器官靶向性限制了其进一步临床应用。递送Cas9核糖核蛋白复合物
(Cas9 RNP)
可以有效避免递送Cas9 DNA/mRNA所需的细胞内转录和翻译过程,降低免疫原性和脱靶效应,是较为理想的递送目标。然而,Cas9 RNP难以穿过细胞膜进入细胞,其较大的分子量导致现有递送系统难以有效包载,成为其转化应用的瓶颈。
近日,浙江大学刘祥瑞、平渊和周天华课题组合作在Science Advances上发表了题为
Exosome-mediated delivery of Cas9 ribonucleoprotein complexes for tissue-specific gene therapy of liver diseases
的研究论文。
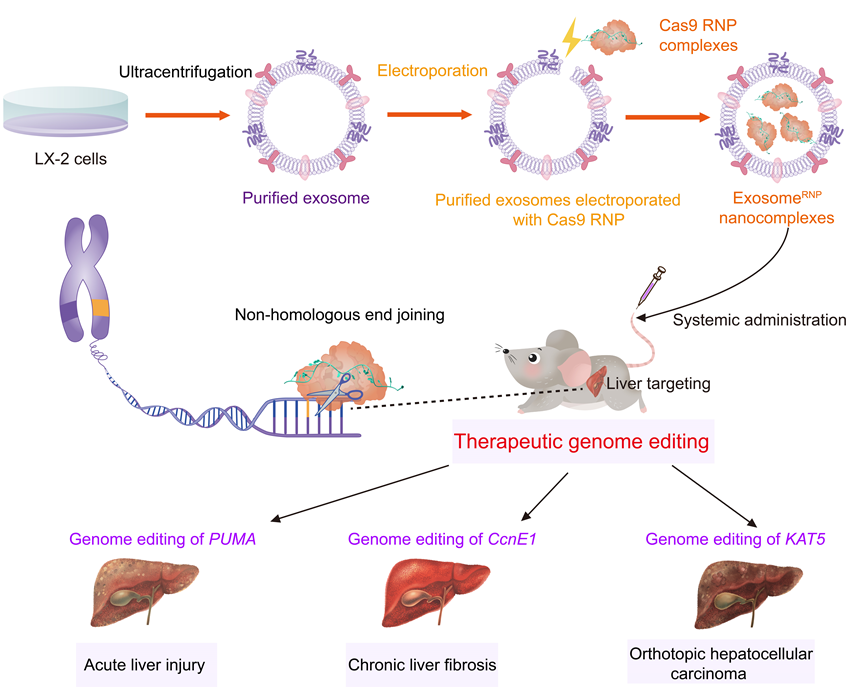
首次采用外源性包载技术将Cas9 RNP装入特定外泌体中,利用外泌体肝靶向作用及内吞促进作用,静脉注射后实现肝脏部位特异性基因编辑。在急性肝损伤、肝纤维化和原位肝癌三种小鼠模型中,实现了肝脏中目标基因的特异性剪切,阻断了疾病发展进程,展现出了优异的治疗性能。
该技术不但实现了Cas9 RNP的体内递送和高效基因编辑,而且避免了非靶器官中的无效编辑,为进一步开发安全有效的CRISPR/Cas9的精准递送系统提供了新思路。
外泌体在生物相容性、药物装载能力、体内靶向性、血流稳定性和可工程化等方面具有独特的优势,成为递送基因编辑核糖核蛋白复合物的理想递送载体。现有将Cas9 RNP包载至外泌体中的方法主要依赖细胞内源性技术,需要事先在细胞中转染CRISPR-Cas9质粒,转录翻译后在特定时间收集该细胞的外泌体,步骤较多,复杂费时且可控性差。本研究采用优化的电穿孔方法避免了质粒转染的复杂过程,在细胞外直接将Cas9 RNP装载至肝成纤维细胞来源的外泌体中,制备获得的外泌体基因编辑纳米颗粒
(ExosomeRNP)
可成功将RNP递送至靶细胞内产生高效的基因编辑效应。值得注意的是,在动物体内ExosomeRNP可通过肝脏蓄积和同源靶向作用,将RNP精准递送至肝脏组织中,避免非靶器官的基因编辑,提高体内基因组编辑的安全性和精准性。
在急性肝损伤、肝纤维化和原位肝癌三种小鼠模型中,利用ExosomeRNP分别针对p53上调凋亡调控因子
(PUMA)
、细胞周期蛋白E1
(CcnE1)
和K-乙酰转移酶5
(KAT5)
实现特异性基因剪切,显著降低了对应蛋白的表达,阻断了疾病进程并展现出了较好的治疗作用。疾病相关指标和病理分析表明剪切PUMA基因可以缓解急性肝损伤,提高了小鼠生存期;剪切CcnE1基因可以降低肝脏炎症,减轻肝纤维化;剪切KAT5基因可对原位肝癌的生长有明显的抑制作用。重要的是,ExosomeRNP介导的基因编辑效应只存在于肝脏中,其他器官及组织中未发现明显的基因编辑现象。
图1. 外泌体递送Cas9 RNP用于肝脏疾病的精准治疗示意图
浙江大学药学院/医学中心万涛博士后研究员和基础医学院/化工学院钟佳锋硕士为该论文共同第一作者,基础医学院刘祥瑞副教授,药学院/医学中心平渊研究员和基础医学院周天华教授为该论文共同通讯作者。相关成果已申请发明专利“一种包载基因编辑核糖核蛋白的外泌体及用途”,申请号:202210644925.4。
原文链接:
http://doi.org/10.1126/sciadv.abp9435
制版人:十一

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。








 药选址
药选址






