
葡萄糖是脑细胞主要燃料。人类大脑约占总体重的2%,但它消耗了全身葡萄糖源能量的20%。在神经退行性疾病,例如阿尔茨海默症发生和发展期间脑能量代谢产生复杂的变化【1】。18F标记的氟代脱氧葡萄糖正电子发射断层扫描 (葡萄糖-PET) 被广泛用于检测脑葡萄糖摄取量,从而间接衡量神经元损伤程度【2】。然而,葡萄糖-PET缺乏细胞分辨率,无法辨别对PET信号有贡献的细胞类型。前期大量研究指出神经突触活动是葡萄糖-PET信号主要来源于,因此临床上,葡萄糖-PET信号的强弱与神经活动直接挂钩【3-5】。但是,在阿尔茨海默症的病理分子b-淀粉样蛋白(Ab)积累早期,患者的葡萄糖-PET信号显示出短暂的区域性增加【6-8】。此类疾病前期的脑葡萄糖摄取量区域性增加的原因和机制尚未阐明。
2021年10月13号,慕尼黑大学Matthias Brendel 和 Christian Haass课题组 (第一作者为项贤媛博士)在Science Translational Medicine 上在线发表了题为 Microglial activation states drive glucose uptake and FDG-PET alterations in neurodegenerative diseases 的文章, 修正人们对脑葡萄糖-PET成像的理解,助力神经退行性疾病的早期诊断。该文章阐述了葡萄糖-PET信号直接受大脑中的免疫细胞葡萄糖摄取量的影响,大脑中的免疫细胞的活动状态是导致患者早期葡萄糖-PET信号改变的原因。

在该研究中,作者分析了在小鼠模型和神经退行性疾病患者中,葡萄糖-PET成像结果是否直接受小胶质细胞葡萄糖摄取的影响。当18F标记的氟代脱氧葡萄糖注射到体内,氟代脱氧葡萄糖会被快速吸收并且停留在细胞内,其放射性信号能被检出,从而反映该细胞或组织的葡萄糖摄取能力。作者在不同的小鼠模型中注射此类葡萄糖后,分选出神经元,星形胶质细胞及小胶质细胞(大脑中主要的免疫细胞),分别检测各种细胞中葡萄糖所释放的放射性信号,从而确定小胶质细胞的葡萄糖摄取量高于神经元和星形胶质细胞。当小胶质细胞缺失TREM2 (髓样细胞上表达的触发受体2,一种参与代谢和活化的小胶质细胞基因) ,其葡萄糖摄取能力明显下降,因此缺失TREM2的小鼠显示更低的葡萄糖-PET信号。作者收集了阿尔茨海默症及Tau蛋白病病患队列,并进行了葡萄糖-PET成像及小胶质细胞活性-PET(TSPO-PET)成像。在未见明显神经损伤,但已出现病理改变的脑区,葡萄糖-PET与TSPO-PET信号出现明显正相关,提示在患者中小胶质细胞的活性也能直接影响葡萄糖-PET信号。
因此,来自动物模型和临床病人的数据表明,大脑中的免疫细胞小胶质细胞的特点是大量摄取葡萄糖。这些发现直接改变了临床上我们如何解释葡萄糖-PET成像的结果。临床医生了解图像信号的来源至关重要。
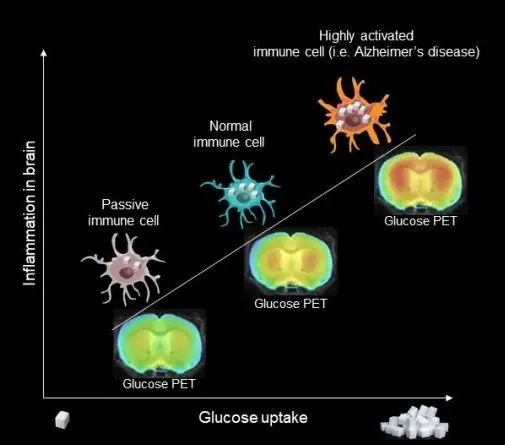
大脑中葡萄糖PET信号几乎完全由神经元功能决定的认识需要被修正,因为由小胶质细胞介导的炎症反应对大脑中的葡萄糖摄取具有至关重要的影响。这一研究对于正确解读葡萄糖-PET数据和指导神经退行性疾病的早期诊断有重要的意义。
附:中国科学院深圳先进技术研究院脑所脑功能与图谱研究中心Helmut Kettenmann教授团队博士后招聘——中国科学院深圳先进技术研究院 (siat.ac.cn),详情请见Kettenmann Lab (x-mol.com)
原文链接:
https://www.science.org/doi/10.1126/scitranslmed.abe5640
参考文献
1. C. R. Jack, Jr. et al., Tracking pathophysiological processes in Alzheimer's disease: an updated hypothetical model of dynamic biomarkers. Lancet Neurol 12, 207-216 (2013).
2. C. C. Tang et al., Differential diagnosis of parkinsonism: a metabolic imaging study using pattern analysis. Lancet Neurol 9, 149-158 (2010).
3. L. Sokoloff et al., The [14C]deoxyglucose method for the measurement of local cerebral glucose utilization: theory, procedure, and normal values in the conscious and anesthetized albino rat. J Neurochem 28, 897-916 (1977).
4. L. Sokoloff, Energetics of functional activation in neural tissues. Neurochem Res 24, 321-329 (1999).
5. L. Sokoloff, Sites and mechanisms of function-related changes in energy metabolism in the nervous system. Dev Neurosci 15, 194-206 (1993).
6. H. Oh, C. Habeck, C. Madison, W. Jagust, Covarying alterations in Abeta deposition, glucose metabolism, and gray matter volume in cognitively normal elderly. Hum Brain Mapp 35, 297-308 (2014).
7. B. A. Gordon et al., Spatial patterns of neuroimaging biomarker change in individuals from families with autosomal dominant Alzheimer's disease: a longitudinal study. Lancet Neurol 17, 241-250 (2018).
8. T. L. Benzinger et al., Regional variability of imaging biomarkers in autosomal dominant Alzheimer's disease. Proc Natl Acad Sci U S A 110, E4502-4509 (2013).
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




