
FDA批准的首个单克隆抗体(mAb)药物(1986年批准上市)是仅1mg/mL的低蛋白浓度muromonab-CD3(Orthoclone OKT3)制剂。截至2021年10月,FDA在过去的35年中批准了103种治疗性抗体药物,包括抗体药物偶联物等基于抗体的治疗药物上市。这103种抗体药物中的大多数配制为低蛋白浓度(≤50 mg/mL),部分原因是开发抗体药物高浓度制剂面临技术挑战。
FDA批准数量与批准年份
如图1所示,自2015年以来,FDA批准数量显著增加。2015年以来的批准数量(26个)占总批准数量(34个)的76%,提示近年来生物制药行业对高浓度制剂的需求不断增加。
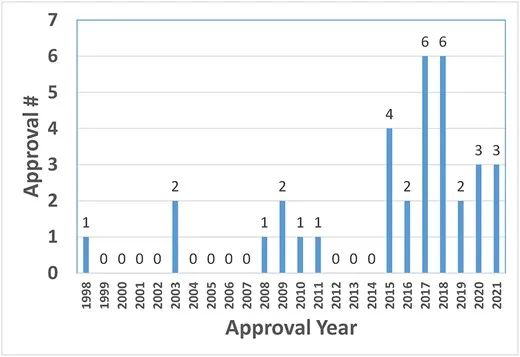
1998-2021年期间,FDA批准高浓度制剂治疗性抗体的数量
对FDA批准的34种治疗性抗体的高浓度制剂辅料进行了分析。计算这34种抗体中各处方组成中所用处方辅料的频率,频率超过10%的主要处方辅料有聚山梨酯(94%,包括聚山梨酯20和聚山梨酯80)、组氨酸(82%)、蔗糖(48%)、精氨酸(27%)、氯化钠(NaCl,18%)、蛋氨酸(18%)、醋酸盐(12%)和海藻糖(12%)。频率低于10%的其他处方辅料为脯氨酸、山梨醇、磷酸钠、泊洛沙姆188、乙二胺四乙酸(EDTA)、柠檬酸、甘露醇、谷氨酸盐、甘氨酸、柠檬酸钠、琥珀酸钠和乳酸。
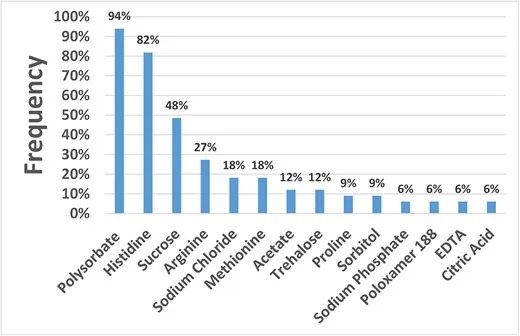
FDA批准的治疗性抗体高浓度制剂辅料分析
34种高浓度制剂抗体的剂型可分类如下:仅液体溶液(Liq)、冻干粉(Lyo)、仅预充式注射器(PFS)以及PFS和Lyo。Liq剂型为西林瓶装液体,PFS也代表预充式注射器装液体。Liq和PFS规格主要占据市场份额,分别为43%和39%,其次是PFS和Lyo,均为12%。出乎意料的是,这34种抗体中只有6%(2种产品)仅配制为冻干粉(Lyo)。
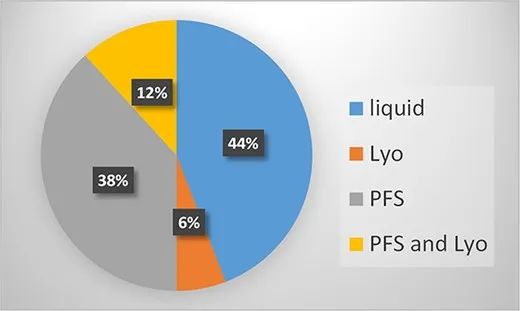
FDA批准的治疗性抗体高浓度制剂剂型分析
浓度分析
研究分析了两个浓度范围的蛋白浓度,即100-150 mg/mL,其中包括100 mg/mL的下限,但不包括150 mg/mL的上限;和150-200 mg/mL,其中包括150 mg/mL的下限和200 mg/mL的上限。100-150 mg/mL(56%)范围内的制剂略高于150-200 mg/mL(44%)。产品Benlysta(Belimumab)和Cimzia(赛妥珠单抗)的最高蛋白质浓度为200 mg/mL。
给药途径分析
34种高浓度制剂抗体的给药途径包括4种类型:眼内注射(IVI)、静脉内(IV)、肌内(IM)和皮下(SC)。与预期一致,主要给药途径是SC(26种产品,76%),其次是IV(5种产品,15%)、IVI(2种产品,6%)和IM(1种产品,3%)。唯一经IM给药途径的抗体是Synagis(帕利珠单抗),如上所述,Synagis是FDA批准的首个高浓度抗体产品。两种IVI给药的抗体产品是Beovu(Brolucizumab-dbll)和Susvimo(Ranibizumab),后者于2021年10月被FDA批准通过眼植入物玻璃体内使用,用于治疗新生血管性或“湿性”年龄相关性黄斑变性(nAMD)患者。尽管Beovu和Susvimo具有相同的适应症(nAMD)和相同的给药途径(IVI),但Susvimo(Ranibizumab)通过特殊系统递送。该系统被称为输液港给药系统(PDS),可通过可再填充植入物将雷珠单抗药物连续递送至眼内。因此,每年仅进行两次治疗,Susvimo可以帮助nAMD患者保持视力。

FDA批准的高浓度制剂治疗性抗体的给药途径分析
将这些申办方划分为三个不同的层级,即1级(8个获批产品)、2级(1.5-4个获批产品)和3级(0.5-1个获批产品)。只有罗氏及其子公司(基因泰克和中外制药)属于1级类别,有8种高浓度的获批抗体(包括与其他公司共同申办的2种获批抗体)。批准数量从1.5到4的2级申办方包括诺华(4个获批)、赛诺菲(2.5个获批)、安进(2个获批)、GSK(2个获批)、强生包括其子公司杨森(2个获批)、再生元(1.5个获批)和Biogen(1.5个获批)。
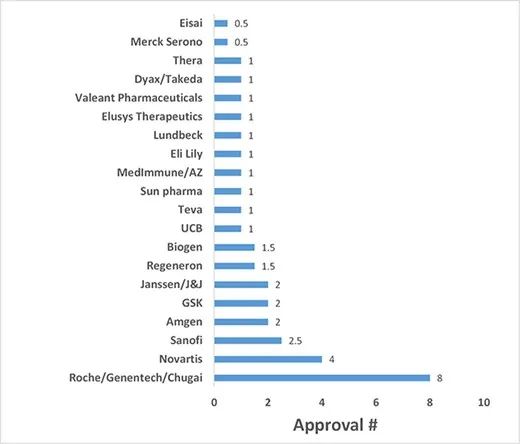
FDA批准的高浓度制剂治疗性抗体的申办方vs.获批数量分析
34种抗体中的大多数是IgG1(22/34),其次是IgG2(5/34)、IgG4(5/34)和其他IgG类型(2/34)。其他IgG类型包括单链可变片段(scFv、Beovu/Brolucizumab-dbll)和抗原结合片段(Fab、Cimzia/Certolizumab pegol)。
讨论和展望
值得注意的是,所有这34种高浓度抗体要么是裸全长IgG,要么是抗体片段(scFv和Fab)。迄今为止,尚无抗体药物偶联物(ADC)。这是因为与ADC相关的特殊配方挑战,如连接体的稳定性和ADC的溶解度。此外,迄今为止FDA批准的所有11种ADC药品制剂均以冻干形式生产,复溶ADC溶液的蛋白质浓度较低,部分原因是上述稳定性和溶解度问题。因此,抗体药物的高浓度制剂将是未来治疗性抗体制剂开发的趋势,所有这些挑战和问题都是可以解决的。




 个人中心
个人中心
 我是园区
我是园区




