
8月4日,阿卡迪亚(Acadiaia)宣布FDA就pimavanserin用于治疗与阿尔茨海默症精神病相关幻觉和妄想的补充新药上市申请(sNDA)发出完整回复函(CRL)。

根据阿尔茨海默症协会统计,美国约有600万人患有阿尔茨海默症。阿尔茨海默症是一种病因未明的进行性神经退行性疾病,临床特征为记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等,其中约30%的AD患者会出现精神病相关的幻觉和妄想。
pimavanserin是一种选择性5-羟色胺(5-HT)反向激动剂和拮抗剂,优先靶向5-HT2A受体,于2016年4月获批,商品名为nuplazid,是首款治疗与帕金森病精神病(PDP)相关的幻觉和妄想的药物,2021年全球销售收入达4.84亿美元。此外,Acadiaia正在进行pimavanserin治疗其他精神疾病的临床试验。
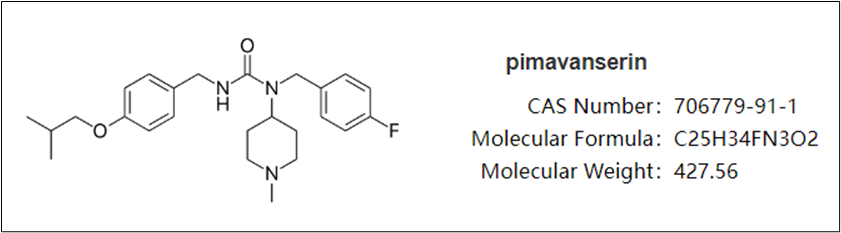
2020年6月,基于III试验Study 045(HARMONY)的关键结果,Acadiaia向FDA递交了pimavanserin用于治疗阿尔茨海默症精神病相关幻觉和妄想的补充新药上市申请。
2021年4月,FDA认为该疗法在某些痴呆症患者亚组中缺乏统计学意义,因此拒绝了该申请。Acadiaia于2022年2月重新递交了申请,额外纳入了Study 045和II期试验Study 019的数据分析,并将适应症改为ADP相关的幻觉和妄想。
CRL内容表明,FDA认为当前基于Study 019和Study 045试验的数据不足以支持pimavanserin在美国获批,并建议Acadiaia增加针对ADP的额外试验。
FDA表示,Study 019研究在主要终点达到了具有统计学意义的显著治疗效果,但他们认为该研究结果的可解释性存在局限性。此外,FDA表示,在Study 045试验中,pimavanserin对DRP的积极治疗效果同样不可信,因为50%的PDP患者都患有痴呆症,而该研究中的PDP痴呆症亚组的治疗效果也非常积极。
Acadiaia首席执行官Steve Davis说:
“我们对这一结果感到失望。阿尔茨海默症精神病的临床治疗需求仍然高度未满足,目前尚无相关疗法获批。我们感谢所有参与临床试验的患者及其家人和研究人员。 ”







 个人中心
个人中心
 我是园区
我是园区




