「 本文共:16条资讯,阅读时长约:3分钟 」


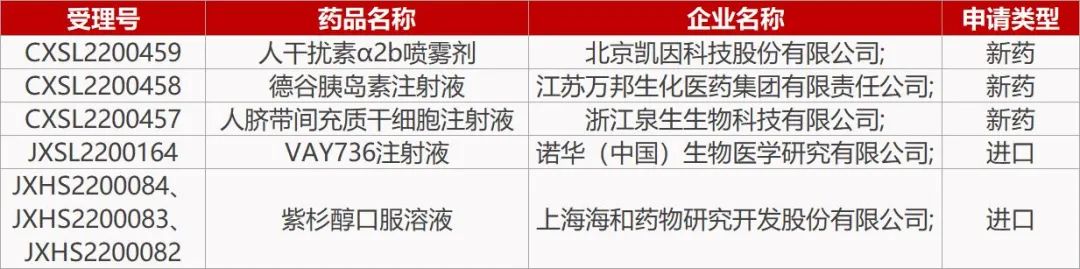
首个紫杉醇口服制剂在华报产。海和药物和大化制药合作开发的紫杉醇口服液(Liporaxel)的上市申请获CDE受理,适应症为二线治疗晚期胃癌。Liporaxel是由大化制药基于其创新的脂质自乳化药物递送技术开发,是首个获批上市的口服紫杉醇产品,已于2016年9月在韩国获批用于晚期或转移性胃癌或局部复发性胃癌的二线治疗。海和拥有该产品在中国大陆、台湾、香港及泰国研发、生产及销售权益。


1.天境CD47单抗获批III期注册临床。天境生物宣布其CD47抗体药物来佐利单抗获国家药监局批准一项III期注册性临床,拟评估联合阿扎胞苷治疗初诊较高危骨髓增生异常综合征(HR-MDS)的有效性与安全性。在II期研究(NCT04202003)中,该联合疗法治疗6个月时达到86.7%的客观缓解率和40%的完全缓解率。而且联合治疗总体耐受性良好,安全性与阿扎胞苷单药治疗相当。
2.上海医药肾素抑制剂获批UC临床。上海医药申报的1类化药SPH3127片获国家药监局批准开展Ⅱ期临床试验, 拟定适应症为用于溃疡性结肠炎(UC)的治疗。SPH3127片是一种新型口服肾素抑制剂,具有降血压作用,该新药用于治疗原发性轻中度高血压的临床开发在中国已处于III期临床阶段。此外,SPH3127片也正在一项Ⅱ期临床中评估用于治疗糖尿病肾病的潜力。
3.成都赜灵JAK3抑制剂获批UC临床。成都赜灵生物开发的1类创新药物“ZL-82片”获国家药监局临床默示许可,拟用于溃疡性结肠炎(UC)的治疗。UC是一种慢性免疫介导的胃肠道炎症(IBD)。ZL-82是一款JAK3高选择性抑制剂,相比于已上市的3款治疗UC的JAK激酶抑制剂,ZL-82 具有高效、低毒的优势。据统计,2020年全球TOP100销售额药品中,涉及治疗IBD的有7款药物,累计销售额达429亿(覆盖了其他风湿性等自免疾病)。
4.绿叶VMAT2抑制剂在美获批临床。绿叶制药新一代囊泡单胺转运蛋白2(VMAT2)抑制剂LY03015获FDA批准开展I期临床。LY03015是绿叶制药基于其新分子实体/新治疗实体技术平台(NCE/NTE)开发的中枢神经领域创新药,拟用于治疗迟发性运动障碍(TD)、亨廷顿舞蹈病(HD)。临床前结果表明:LY03015能够避免脱靶效应带来的抑郁及自杀风险;具有更理想的消除半衰期和组织分布特性,可实现每天口服一次的用药方式、降低心脏QT间期延长的风险。
5.创胜Gremlin1靶向抗体在美获批临床。创胜集团靶向Gremlin1的单抗药物TST003获FDA临床许可。TST003是一款新型免疫调节蛋白靶向抗体候选药物,该蛋白由肿瘤相关成纤维细胞或具有间充质表型的肿瘤细胞产生。在临床前研究中,TST003作为单药或与靶向药物联用时在靶标表达的人源肿瘤异种移植(PDX)模型中已表现出抗肿瘤活性。此外,该产品作为单药显示出抗肿瘤活性,且在多个同基因肿瘤模型中增强了检查点抑制剂的抗肿瘤活性。


1.大冢阿立哌唑长效剂型报NDA。大冢制药与灵北联合开发的即用型阿立哌唑2个月长效注射剂(Aripiprazole 2-month, Ready-to-Use, Long-acting Injectable)的上市申请获FDA受理,用于治疗双相I型障碍和成人精神分裂症,PDUFA日期为2023年4月27日。阿立哌唑即用型2个月长效注射剂以预充式注射器的形式提供给患者,无需重装,每2个月经肌肉注射给药,为成人精神分裂症和双相情感障碍患者提供新的治疗选择。
2.罕见儿科疾病新药「曲非奈肽」报NDA。Acadia公司胰岛素样生长因子1(IGF-1)氨基末端三肽的新型合成类似物Trofinetide(曲非奈肽)用于治疗成人和2岁以上瑞特(Rett)综合征的上市申请获FDA受理,FDA同时授予其优先审评,PDUFA日期为2023年3月12日。这是一种罕见遗传性神经发育障碍,由一种叫做MECP2.3的基因的X染色体突变引起,通常发生在女童身上。目前,FDA还没有批准任何治疗Rett综合征的药物。
3.诺华可善挺化脓性汗腺炎两项III期研究成功。诺华IL-17A抑制剂Cosentyx治疗中重度化脓性汗腺炎(HS)的两项关键III期研究(SUNSHINE和SUNRISE)结果积极。与安慰剂相比,接受每两周一次Cosentyx 300mg治疗的患者在第16周获得临床反应(HiSCR)的比例显著更高(45.0%vs33.7% [P=0070],42.3%vs31.2% [P=0.0149])。而接受每4周一次Cosentyx 300mg治疗的患者的这一数值在SUNRISE研究中达到46.1%(vs31.2% [P=0.0022]),但在SUNSHINE研究中未达到统计学意义(41.8%vs33.7% [P=0.0418])。诺华计划将数据尽快向FDA提交。
4.补体C5抑制剂治疗GA的III期临床成功。Iveric Bio公司补体C5抑制剂Zimura治疗地图样萎缩(GA)的Ⅲ期临床达到主要终点。12个月治疗结果显示,Zimura组患者的GA面积平均增长率与对照组相比,降低14.3%(p=0.0064);患者的最佳矫正视力(BCVA)出现有利趋势,这与之前GATHER1研究一致;但Zimura未能显著改善患者的低亮度最佳矫正视力。药物的总体耐受性良好。该公司计划明年第一季度提交Zimura上市申请。
5.NASH新药每周1次皮下注射Ⅱ期临床积极。Akero公司Fc-FGF21融合蛋白Efruxifermin每周一次治疗非酒精性脂肪性肝炎(NASH)的IIb期HARMONY研究达到主要终点以及多个次要终点。与安慰剂相比,Efruxifermin(28mg或50mg)治疗组第24周时,分别有39%和41%的患者实现至少一个阶段的肝纤维化改善且NASH没有恶化(vs20%);分别有47%和76%的患者在肝纤维化不恶化的情况下获得NASH缓解(vs15%);分别有29%和41%的患者达到肝纤维化改善和NASH缓解两个终点(vs5%)。此外,Efruxifermin耐受性良好。
6.口服胰岛素新药治疗NASH达Ⅱ期临床终点。Oramed公司口服胰岛素ORMD-0801治疗伴有非酒精性脂肪性肝炎(NASH)的2型胰岛素患者的Ⅱ期临床达到主要终点。与安慰剂相比,ORMD-0801(8mg)每日两次的给药剂量显示出良好的安全性和耐受性,两组的不良事件比例相似。针对肝脏脂肪水平、脂肪变性和纤维化的测量,以及脂质和糖化血红蛋白(HbA1c)水平的测量,所有检测结果显示ORMD-0801较安慰剂具有更好的效果。


1.国家医保局回复将缺失牙修复纳入医保报销建议。针对人大代表提出的关于将缺失牙修复纳入医保报销范畴的建议,国家医疗保障局日前回复表示,为解决群众“看牙贵”问题,按照国务院常务会议部署,我们指导和推动四川医保局牵头种植牙耗材省际联盟采购,倡导全国各地积极参加。目前已会同四川医保局开展了大量摸底调研,并征求有关专家意见,形成初步的思路和方案,目前正在加紧修改完善。
2.江西对4类重点人群实施医疗救助。江西省政府日前印发《江西省人民政府办公厅关于健全重特大疾病医疗保险和救助制度的实施意见》,将于10月1日起实施。《实施意见》明确,将特困人员、低保对象、返贫致贫人口,纳入监测范围的农村易返贫致贫人口(脱贫不稳定、边缘易致贫和突发严重困难人口),因病支出型困难家庭患者,以及县级以上人民政府规定的其他特殊困难人员等4类重点人群,确定为医疗救助对象,孤儿参照特困人员享受救助待遇。
3.全自动核酸检测平台获批上市。上海之江生物研发的“小青耕”全自动核酸检测平台获国家药监局批准上市,成为国内体积最小的全自动“磁珠法+荧光PCR(聚合酶链式反应)”核酸检测系统。与该公司之前获批的核酸检测一体机“青耕一号”相比,“小青耕”更集约紧凑,单台设备仅45公斤,可放置在桌面,适用于发热门诊、急诊、移动车载等空间有限的场所,快速灵活地满足个性化需求。





上个交易日 A 股医药板块 -0.64%
涨幅前三 跌幅前三
龙津药业 +4.55% 中 关 村 -4.76%
前沿生物 +4.15% 黄山胶囊 -4.43%
安图生物 +3.47% *ST 必康- 4.20%
【吉贝尔】收到化学原料药上市申请批准通知书。化学原料药名称:阿替洛尔(Atenolol)。化学原料药注册标准编号:YBY62452022。
【恒瑞医药】收到国家药品监督管理局核准签发关于HRS-6209胶囊的《药物临床试验批准通知书》,将于近期开展临床试验。
【泽璟制药】盐酸杰克替尼片用于治疗活动性强直性脊柱炎II期临床试验取得成功结果。
- The End -





 个人中心
个人中心
 我是园区
我是园区




