▎药明康德内容团队编辑
Urovant Sciences公司今天宣布,美国FDA已批准该公司开发的β3肾上腺素能受体激动剂Gemtesa(vibegron)上市,用于治疗伴有急迫性尿失禁(UUI)、尿急和尿频症状的膀胱过度活动症(OAB)成人患者。新闻稿指出,这一批准是自2012年以来FDA批准治疗这类患者的首个创新口服处方药物。这也是美国FDA的药物评估与研究中心(CDER)今年批准的第53款创新药。在新冠疫情给FDA的审评工作带来重大压力的情况下,目前为止,CDER批准的创新药数目仅次于2018年创纪录的59款,体现了FDA将创新疗法早日带给患者的努力。

膀胱过度活动症是膀胱肌肉不自主收缩时发生的临床病症。症状可能包括尿急(难以控制的突然急迫性排尿)、急迫性尿失禁(在急迫性排尿后立即无意中排尿)、尿频(通常在24小时内排尿8次或更多次)和夜尿(夜间醒来排尿超过2次)。OAB令人烦恼的症状可能对患者的日常活动造成显著损害。
Gemtesa是一款每日口服一次的β3肾上腺素能受体激动剂。研究表明,它能够选择性地激活β3肾上腺素能受体,这是膀胱平滑肌中最常见的β肾上腺素能受体,从而舒张平滑肌,提高膀胱容量,进而减轻OAB的症状。
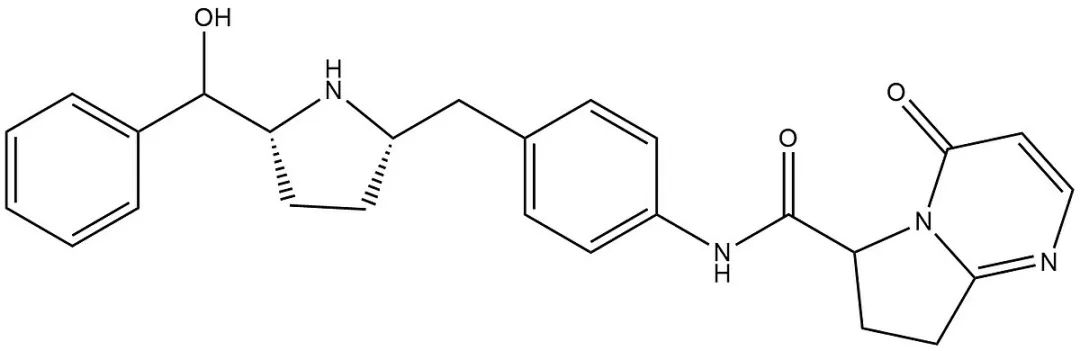
▲Gemtesa分子结构式(图片来源:Guðjón Trausti Skúlason, CC BY-SA 4.0
FDA的批准是基于包括超过4000例OAB患者的广泛临床开发项目的结果,包括一项为期12周的双盲、含安慰剂对照的3期临床试验EMPOWUR,和双盲EMPOWUR长期扩展研究。这些试验数据显示,与安慰剂相比,Gemtesa导致患者每日UUI、排尿和尿急发作次数显著减少,排尿量增加。
“Gemtesa是首个每日一次,不需要剂量滴定的β3激动剂。”临床试验负责人,波士顿圣伊丽莎白医学中心(St. Elizabeth’s Medical Center)泌尿科医生David Staskin博士说,“值得注意的是,在关键性EMPOWUR研究中,与安慰剂相比,Gemtesa没有增加任何高血压不良事件的出现,也没有与经CYP2D6代谢的药物发生相互作用,这一点很重要,因为许多常见药物都是经CYP2D6代谢的。”
“FDA批准Gemtesa对于数千万膀胱过度活动症患者来说是个重要的里程碑。我们期待在未来几个月推出Gemtesa,并相信它将为许多有膀胱过度活动负担的患者提供一个令人信服的替代方案。”Urovant Sciences总裁兼首席执行官Jim Robinson先生说。
注:本文旨在介绍医药健康研究,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1] Urovant Sciences Announces U.S. FDA Approval of GEMTESA® (vibegron) 75 mg Tablets for the Treatment of Patients with Overactive Bladder (OAB). Retrieved December 23, 2020, from https://www.businesswire.com/news/home/20201223005534/en
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。




 个人中心
个人中心
 我是园区
我是园区




