
损伤损害了我们的上皮屏障,使其容易受到外部威胁。因此,有机体的存活取决于损伤后上皮屏障的快速重建。免疫力低下的人和免疫缺陷的动物均存在着严重的上皮修复缺陷。然而,损伤后免疫-上皮交谈的确切机制和后果仍未完全确定。
上皮修复需要细胞通过进化上保守的缺氧诱导因子(hypoxia-inducible factor, HIF)来适应缺氧的伤口微环境。长期以来,人们认为这种反应取决于上皮细胞对缺氧的自主感应和通过HIF的反应能力。然而,在上皮修复过程中,来自免疫细胞的支持性微环境信号是否以及如何与古老的缺氧反应相互作用,还有待于探索。
为了解决这些问题,来自美国纽约大学的研究人员在一项新的研究中着重关注一类主要的上皮屏障---皮肤,它受到免疫细胞的监视,并已进化出复杂的修复机制。相关研究结果发表在2022年7月8日的Science期刊,论文标题为“Interleukin-17 governs hypoxic adaptation of injured epithelium”。

通过对修复相关的淋巴细胞进行无偏见的分析,这些作者发现了17型淋巴细胞的异质性群体的富集。缺少RORγt+细胞的纯合子Rorgt-EGFP小鼠(下称GFI-KI小鼠)在上皮迁移和伤口在上皮化方面表现出明显的缺陷。损伤后,他们观察到预先存在的皮肤驻留RORγt+细胞出现快速局部扩张,足以驱动修复。在众多伤口RORγt+细胞群体中,空间转录组学和功能研究显示,类先天性γδT细胞(innate-like γδ T cell)通过定位到伤口前沿并促进上皮细胞迁移来指导组织修复。这些类先天性γδT细胞在伤口微环境中主要产生IL-17A/F,它通过IL-17RC直接向上皮细胞发出信号,诱导迁移程序。
对缺乏RORγt+细胞的伤口边缘和野生型(WT)伤口边缘的比较空间转录组学分析显示了这两者存在HIF1α信号差异。迁移到野生型伤口边缘的上皮细胞有强劲的细胞核HIF1α激活,而缺乏RORγt+细胞和上皮细胞IL-17RC的小鼠(下称Il17rcEKO小鼠)明显缺乏这种激活。因此,上皮细胞特异性HIF1α缺失的小鼠(下称Hif1aEKO小鼠)表现出GFP-KI小鼠和Il17rcEKO小鼠的伤口愈合缺陷。然而,与GFI-KI小鼠的伤口相反,重组IL-17A无法增强Hif1aEKO小鼠的修复能力,这强调了这种转录效应蛋白在IL-17A信号传导下游介导再上皮化的必要性。
缺乏RORγt+细胞的小鼠和对照小鼠的伤口缺氧水平相当,表明缺乏RORγt+细胞的小鼠不能诱导HIF1α并不依赖于氧气感应。相反,IL-17A足以在体内和上皮类器官中激活上皮细胞HIF1α。IL-17RC信传导号通过mTOR迅速诱导ERK和AKT的激活,从而提高了HIF1α蛋白和转录本的水平,但并没有提高稳定性。急性缺氧在体外有力地激活了上皮细胞HIF1α,这种反应被IL-17A进一步提升。相比之下,这些作者发现在慢性缺氧的情况下,mTOR和HIF1α显著减少。外源性IL-17A在慢性缺氧条件下拯救了mTOR,并因此拯救了HIF1α,这表明IL-17A作为第二信号,使细胞适应低氧环境。
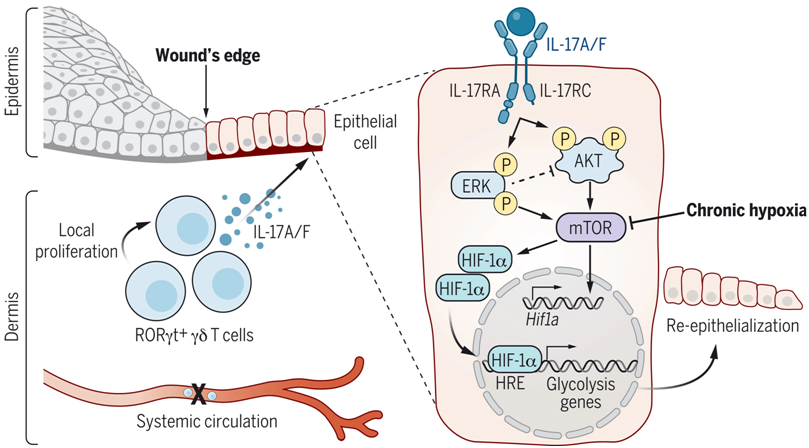
IL-17通过糖酵解驱动上皮细胞HIF1α为伤口修复提供燃料。图片来自Science, 2022, doi:10.1126/science.abg9302。
IL-17A诱导了上皮细胞中糖酵解代谢的转录程序和功能程序,这依赖于mTOR和HIF1α。IL-17A-HIF1α依赖性的糖酵解程序促进了上皮细胞的迁移,而药物抑制糖酵解则损害了伤口的再上皮化。
综上所述,这项新研究的发现颠覆了长期以来的观点,即缺氧足以自主诱导HIF1α介导的代谢重塑。这些作者指出,由RORγt+ γδ T细胞提供的IL-17A对于伤口边缘上皮中的最佳HIF1α激活是必需的。IL-17A-HIF1α轴指导受损上皮细胞的代谢重构,使其走向糖酵解程序以促进上皮细胞迁移。HIF1α和糖酵解是肿瘤进展和转移的驱动因素,这提高了IL-17A或其他免疫源性信号在癌症中驱动这些通路的可能性。IL-17A也在许多自身免疫性疾病(包括银屑病和炎症性肠病)的病理中起着至关重要的作用。因此,这项新的研究揭示的IL-17A-HIF1α轴可能为一系列上皮性炎症和转移性疾病提供治疗机会。
参考资料:
Piotr Konieczny et al. Interleukin-17 governs hypoxic adaptation of injured epithelium. Science, 2022, doi:10.1126/science.abg9302.



 个人中心
个人中心
 我是园区
我是园区




