▎药明康德内容团队报道
7月5日,中国国家药品监督管理局(NMPA)药品审评中心(CDE)最新公示,乐普生物已递交其核心产品普特利单抗注射液新药上市申请,并获得受理。公开资料显示,普特利单抗是一款研发代号为HX008的抗PD-1抗体。此前乐普生物曾发新闻稿称,计划于2021年分别就HX008治疗黑色素瘤和卫星不稳定(MSI-H)/错配修复功能缺陷(dMMR)实体瘤,向NMPA提交新药上市申请。

根据乐普生物在港交所递交的招股资料,HX008(pucotenlimab)是通过使用人IgG4亚型针对人PD-1的人源化单抗。HX008可拮抗PD-1信号,以通过阻断PD-1与其配体PD-L1及PD-L2的结合来恢复免疫细胞杀死癌细胞的能力。
据介绍,HX008创新性地采用抗体工程技术,于Fc区引入突变,提高FcRn的结合亲和力,从而大幅延长其半衰期,提高患者的临床疗效及药物依从性。在已完成的1a期临床试验中,HX008的半衰期为17.15至23.51天(单次给药)及18.41至38.16天(稳定)。
在所有已完成的1期及2期临床试验中,HX008对多种适应症均表现出出色的疗效及良好的安全性。针对MSI-H/dMMR实体瘤的2期临床试验中,候选药的总响应率(ORR)及疾病控制率(DCR)分别达到44.8%及66.7%。针对黑色素瘤的临床试验中,ORR及DCR分别达到18.5%及44.5%。
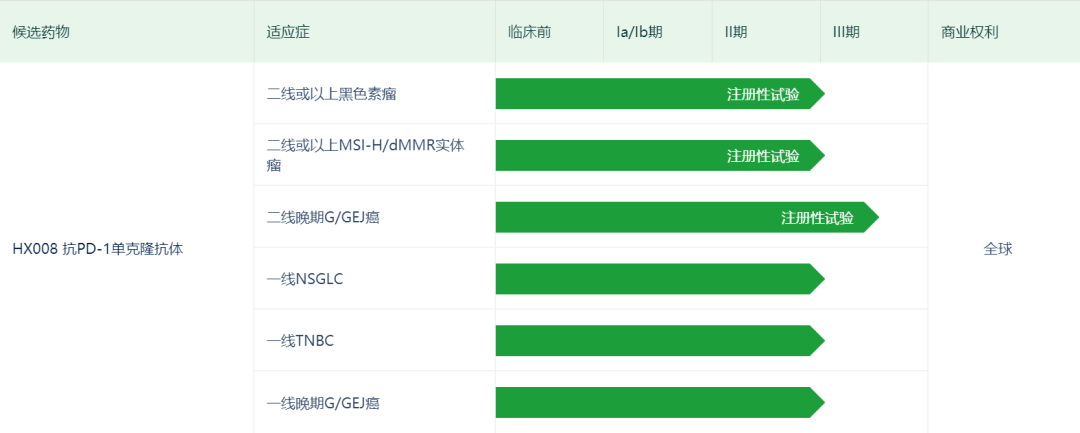
目前,乐普生物正在进行HX008的多项临床试验,包括胃癌或胃食管结合部癌二线治疗的3期临床试验、非小细胞肺癌(NSCLC)的2/3期临床试验,以及分别针对三阴性乳腺癌(TNBC)、非肌层浸润性膀胱癌(NMIBC)、肝细胞癌(HCC)等适应症的2期临床试验等。
此外
,该公司还
正在进行两项关于HX008联合治疗的临床试验,包括HX008联合溶瘤病毒候选药物OH2治疗晚期肝癌,
及HX008联合抗PD-L1抗体候选药物LP002治疗抗PD-1疗法难治的晚期黑色素瘤等。
希望该产品在临床开发中进行顺利并早日获批,造福更多癌症患者。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]中国国家药监局药品审评中心(CDE). Retrieved July 05,2021, from http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=3
[2]
乐普生物招股书. Retrieved Apr 28, 2021, from https://www1.hkexnews.hk/app/sehk/2021/103373/documents/sehk21042802764_c.pdf
[3]乐普生物差异化PD-1单抗,临床优势初显Retrieved Jun 7, 2021, from https://mp.weixin.qq.com/s/hnSAXZWnfXFrH3z2vdT6HA
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。




 药选址
药选址

