速递!德昇济医药KRAS抑制剂在中国获批临床
收藏
关键词:
抑制剂制剂获批获批临床临床医药药
资讯来源:医药观澜 + 订阅账号
发布时间:
2022-08-24
▎医药观澜/报道
8月24日,中国国家药监局药品审评中心(CDE)官网最新公示,德昇济医药开发的KRAS G12C抑制剂D3S-001胶囊获得两项临床试验默示许可,拟开发用于治疗携带KRAS p.G12C突变的晚期实体瘤。D3S-001是德昇济医药首款在研新药,此前已在美国获批开展临床研究,目前正在1期临床试验阶段。
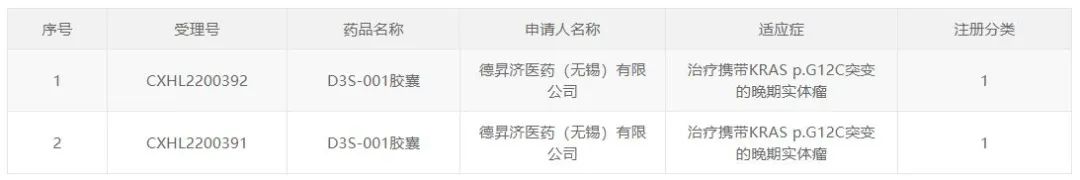
KRAS
是人类癌症中最常出现突变的致癌基因之一,它的突变不仅能直接促进肿瘤细胞的增殖和生存,还能够对肿瘤微环境产生影响。KRAS基因突变有不同的亚型,其中KRAS G12C占所有KRAS突变的44%。研究显示,KRAS基因突变存在于多种肿瘤中,其中G12C突变主要存在于肺癌、结直肠癌和胰腺癌,因此KRAS G12C抑制剂有望成为这类肿瘤患者的有效治疗手段。
德昇济医药成立于2020年,致力于以临床价值为导向,开发肿瘤及免疫精准治疗药物。D3S-001是该公司研发的首款在研抗肿瘤创新药。据德昇济医药共同创始人、董事长兼首席执行官
陈之键博士
此前在接受医药观澜采访时的介绍,D3S-001是一款高活性、高选择性、差异化的KRAS G12C抑制剂,具有成药性高,对靶点的抑制性强、抑制速度快、抑制完全,以及安全性好等潜在优势。
在2022年美国临床肿瘤学会(ASCO)年会上,德昇济医药公布了D3S-001的两项临床前研究摘要。临床前综合研究以及人体剂量药代模型结果显示,D3S-001在分子活性、选择性、ADME(吸收、分布、代谢和排泄)以及Tox profile方面都具有显著优势,而且可以在纳摩尔水平上有效地将KRAS G12C蛋白全部锁在其非活性状态。
2022年5月,德昇济医药宣布美国FDA已批准D3S-001的临床试验申请。目前,一项1期临床正在进行中,以评估D3S-001单药治疗携带KRAS p.G12C突变的晚期实体瘤受试者的安全性、耐受性、药代动力学、药效学和初步疗效。本次在中国获批临床意味着该药也将在中国启动临床试验。
根据德昇济医药官网资料,D3S-001之外,该公司产品管线中还有5款在研药物,包括小分子和大分子,拟开发用于治疗结直肠癌、乳腺癌、胃癌、膀胱癌等不同的实体瘤。
相关阅读:
[1]中国国家药监局药品审评中心(CDE)官网. Retrieved Aug 24, 2022, from https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2]德昇济医药官网. From https://www.d3bio.com/
本文来自药明康德内容团队,欢迎个人转发至朋友圈。转发授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。







 个人中心
个人中心
 我是园区
我是园区




