
“论文发表后多位病人家属迫切联系我们,询问治疗方案能否用于临床,以及能否用于他们的家人。在上海疫情封控期间,有些癌症病人在家观察等待治疗。虽然这项成果尚未进入临床,但能在疫情管控期间给病人带来希望,感觉自己多年努力也得到了回报。此外,我们也在积极寻找合作药企,将项目快速转化。”复旦大学研究员,博士生导师--朱棣表示。

图 | 朱棣(来源:朱棣)
视黄酸受体相关孤儿受体γt(retinoic acid receptor-related orphan receptor gamma t, RORγt)是本次工作的研究要点。借助该成果,该团队将逐步实现用 RORγt 激动剂、实现抗肿瘤的单药应用,此外还有望实现 RORγt 激动剂抗肿瘤的联用。
据朱棣介绍,当前全球药企对 RORγt 靶点小分子药物的关注热度高涨,多家国外制药公司针对自身免疫性疾病的治疗开发了 RORγt 抑制剂。尽管针对 RORγt 激动剂的研发起步相对较晚,但由于在癌症免疫治疗中的潜在应用,也使其成为近年的研究热点。
因此,之前研发 RORγt 抑制剂的药企,开始转向研究 RORγt 激动剂,其中进展最快的是 Lycera 公司。2017 年,该公司已经把一个化合物 LYC-55716 推向临床试验阶段。
复旦大学药学院教授、原 GSK 中国药物化学总监王永辉,曾首次发现 RORγt 激动剂与“长”“短”两类不同 RORγt 反向激动剂的受体结合模式、以及功能变换规律。利用基于计算机的辅助药物设计手段,朱棣团队和王永辉团队合作把前期发现的 RORγt 抑制剂,通过微小结构修饰、转换成新型 RORγt 激动剂。
在该研究中,在原国家自然科学基金委课题资助计划、以及上海市科委等部门的经费援助和支持下,朱棣团队、王永辉团队、以及该校药学院副教授谢琼课题组,一起完成了 RORγt 激动剂开发和药理学评价,并合作开展了多个 RORγt 激动剂化合物系列,也开发和评价了一系列创新型 RORγt 激动剂,其中包括 RORγt 激动剂 JG-1 和 8-074。以这两个系列化合物为基础,他们先后在体外和体内两个层面对药效进行验证。
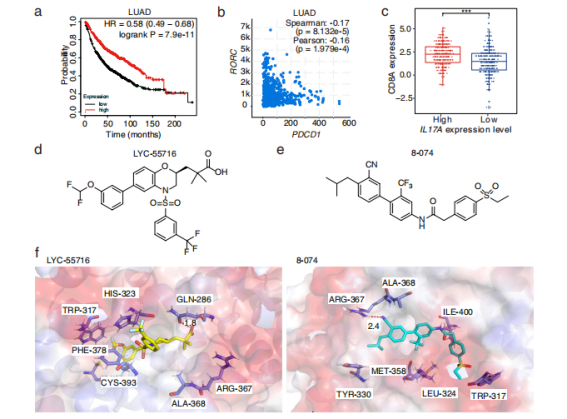
(来源:Journal of Experimental & Clinical Cancer Research)
对于晚期癌症患者而言,目前仍然缺乏有效的治疗手段。而免疫治疗是癌症治疗的革命性疗法,其中 PD-1 抗体的治疗响应,必须依赖 T 细胞在肿瘤中的浸润,而且 PD-1 抗体单药治疗肿瘤患者的客观缓解率(ORR,Objective Response Rate)较低。
说到这里,要先学习一个名词“微卫星不稳定”:它指的是与同一个体的正常组织细胞的 DNA 相比,肿瘤细胞的基因组 DNA 中单个、两个、三个、四个或五个核苷酸组成的重复序列的长度发生了改变。
而 PD-1 抗体治疗仅在一类结肠癌患者、即微卫星高度不稳定的患者中有所响应,对于大部分微卫星高度稳定的结肠癌患者则不响应。目前,尽管肿瘤免疫的新疗法,给血液类癌症带来了治愈希望。然而,这种方法在治疗实体瘤方面,尚未取得实质性突破,主要原因在于肿瘤免疫微环境介导的免疫耐药,影响了免疫响应的发生。
到这里,就得认识一下视黄酸相关孤儿受体γt(RORγt)激动剂。此前,美国生物技术公司 Lycera 研发的 LYC-55716 已进入临床研究,在口服小分子 RORγt 激动剂 LYC-55716 的 I 期临床试验中,11 例复发/难治性的转移癌患者的病情趋于稳定。其中,患者的癌症种类包括非小细胞肺癌、 肉瘤样乳腺癌和子宫内膜癌等。
作为一类重要的辅助性 T 细胞--Th17 细胞的转录因子,对于 RORγt 在肿瘤微环境中增强 PD-1 的抗肿瘤免疫机制,人们依然没弄清楚。要知道,RORγt 控制着 Th17 细胞、Tc17 细胞、以及固有淋巴细胞的分化和维持。非常有意思的是,激活 RORγt 能促进肿瘤免疫响应,从而产生抗肿瘤效果;而抑制 RORγt,则能治疗自身免疫性疾病。
而针对此次开发的的小分子化合物 RORγt 激动剂 8-074 的药物,朱棣对其活性和安全性做了评估。在实体瘤肺癌的治疗中,他还以此为工具探索了 Type 17 T 细胞的作用效果和抗肿瘤机制。
4 月 23 日,相关论文以《RORγt 激动剂通过在癌症中通过 CXCL10 促进单核细胞衍生的树突状细胞来增强抗 PD-1 治疗》(RORγt agonist enhances anti-PD-1 therapy by promoting monocyte-derived dendritic cells through CXCL10 in cancers)为题发表在 Journal of Experimental & Clinical Cancer Research 上(IF 11.161)。

图 | 相关论文(来源:Journal of Experimental & Clinical Cancer Research)
审稿人评价称:“(作者引用大量的)临床数据表明,IL-17A 在肿瘤发生和转移过程中表现出抗肿瘤作用”“(本研究)结果显示,一种名为 8-074 的新型合成 RORγt 激动剂,它能选择性地靶向 RORγt,可以增强鼠 17 型 T 细胞和人类 17 型 T 细胞的分化。”[1]
“ RORγt激动剂前期的 JG-1 成果,已经整理成论文并发表在药理学的著名期刊 Pharmacological Research2。而在本次研究成果中,我们发现 8-074 具有很强的选择性和肿瘤抑制效果,随后对 8-074 的肿瘤抑制作用的药理学机制进行验证。结果发现,相对 Lycera 公司的 LYC55716 药效更好,临床应用前景更好。”朱棣表示。
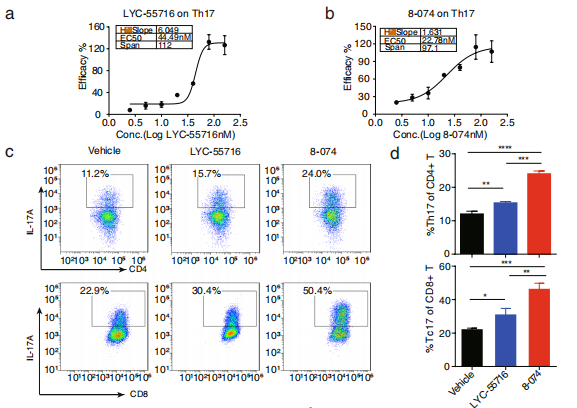
(来源:Journal of Experimental & Clinical Cancer Research)
“创新药研发,九死一生”

研发过程是漫长曲折的,创新药研发更是“九死一生”。有好几次,朱棣的项目都处于“悬崖边”,濒临“死掉”但最终还是坚持下来。“最让我们激动的还是在论文发表后,收到很多肿瘤患者的关注,这让我们感觉到所有付出都是值得的。”他说。
医药研发的时间非常漫长。在朱棣实验室,仅一个新药研发项目就历经三届学生,在这种循环往复中,一届又一届的学生继续研究,已经过 5 年时间。一个博士生毕业后,另一个博士生将课题继续下去。他说:“凭借这种薪火相传,我们的研究还会继续下去。”
而期间也历经数不清的失败,那些已经投入长时间研究的分子,可能并不是目标分子。还有一些分子存在成药性缺陷,这时就得换个新策略把路继续走下去,这也意味着得继续申请经费找钱,换分子骨架继续前行。
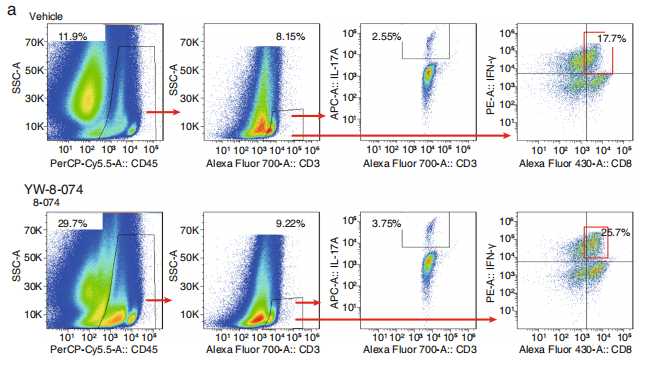
(来源:Journal of Experimental & Clinical Cancer Research)
为相关靶点的药物研发提供理论依据,有望实现和 CART 的联用

在本次成果应用拓展上,朱棣打算逐步实现 RORγt 激动剂抗肿瘤的单药的应用,这一点可分为三点:
第一点指的是,该团队已在肺癌和结肠癌小鼠模型中,发现了 RORγt 激动剂提高 PD-1 抗体响应率的免疫机制,借此为肿瘤免疫临床治疗提供了新思路;
第二点指的是,在多个动物模型中,研究中使用的 RORγt 激动剂 8-074 均显示出较好的抗肿瘤效果。并且,相比阳性药物 LYC-55716,8-074 在体外的活性更佳,这说明其具备潜在的成药性。如果进入临床,未来也有望给患者提供更好的治疗选择;
第三点指的是,在肺癌和结肠癌模型中,该研究也已证明 RORγt 激动剂 8-074,具备抗肿瘤药效和药理学机制,这给靶向 Type 17 T 细胞相关靶点的药物研发提供了理论依据。
而在实现 RORγt 激动剂抗肿瘤的联用应用前景上,这一点又可展开分为两点:
第一点是 RORγt 与免疫检查点抑制剂的联用。
该团队在 2021 年发表了一篇 RORγt 激动剂的相关论文2,研究表明 RORγt 激动剂 JG-1 在多种肿瘤的模型中均具有明显的肿瘤生长抑制作用, 其还发现 JG-1、与细胞毒性 T 淋巴细胞相关的蛋白 4(CTLA-4)抗体,具有协同抑制肿瘤生长的作用。
而此次发表的论文显示,RORγt 激动剂可以提高 PD-1 抗体的疗效。而在免疫检查点抑制剂的开发中,PD-1 和 CTLA-4 是当下最成功的两个靶点。因此,RORγt 激动剂一旦进入临床,它和 PD-1 抗体、以及 CTLA-4 抗体的联用前景十分广阔。
第二点是 RORrt 与 CAR-T 免疫细胞疗法的联用。
过继性 T 细胞转移疗法,是美国食品药品监督管理局(FDA,Food and Drug Administration)批准的治疗白血病疗法,但其依赖于患者体外扩增和回输免疫细胞。因此,可用嵌合体对抗原受体(CAR)进行工程改造,从而更有效地识别肿瘤。而 RORγt 激动剂能增强人体抗肿瘤活性 Th17 和 Tc17 细胞;在体内时,RORγt 激动剂和 CAR-T 细胞的联用,则可消退肿瘤。
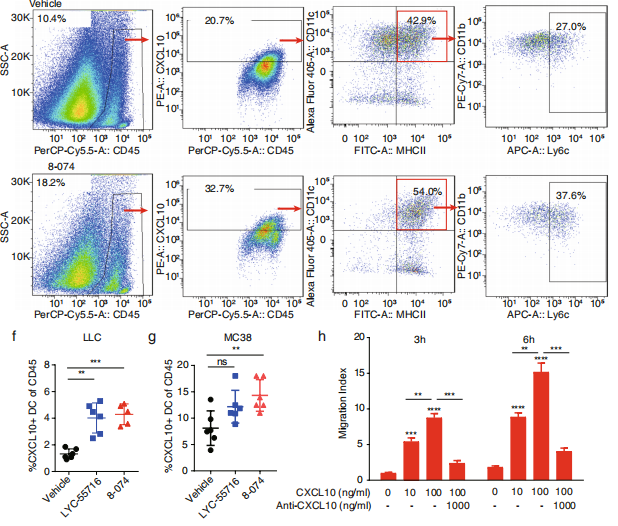
(来源:Journal of Experimental & Clinical Cancer Research)
曾开展针对肿瘤免疫的新型治疗方案,已有两项进入临床

在本次成果之外,朱棣还开发一系列的新型肿瘤免疫治疗方案,目前已有两项进入临床。
第一项是干扰素 α 和 PD-1 抗体的联用。干扰素 α(IFN-α)的临床应用已有十余年,肝细胞癌是中国致死率排第二位的肿瘤类型,同时加上其发病隐匿,约 80% 的患者在首次诊断时已属不可切除、或发生转移的晚期阶段,而且晚期肝细胞癌患者的疾病进展迅速,预后也比较差,5 年生存率仅 12.1%,对于免疫检查点的治疗响应率也比较差。
据该课题组此前研究显示,对于 15 例无法进行手术切除的肝癌患者,给予干扰素 α+PD-1 阻断联合治疗,借此让干扰素+PD-1 阻断的联合治疗效果得以确定。朱棣表示,联合治疗后的 ORR 和 DCR(疾病控制率,disease control rate),分别为 40.0% 和 80.0%,且未出现因治疗导致的死亡病例。
在干扰素 α 和 PD-1 抗体联用的临床试验中,一名 67 岁女性患者曾接受动脉插管化疗栓塞术并随后接受 PD-1 抗体治疗,但由于响应差,导致疾病持续加重。患者肝脏中最大的肿瘤(2.3×4.1厘米)位于 VIII 节段,临近肝门静脉分支。在经过 7 周的干扰素 α+PD-1 抗体联合治疗后,肝脏肿瘤体积显著变小。在后期的随访观察中,患者的肿瘤体积并未出现增加,且未伴随副作用。
第二项是免疫细胞治疗,该团队开发的另一个免疫细胞治疗研发项目,主要应用于癌症晚期治疗。中国绝大多数早期胃癌患者,一般处于良性进展期,存在预后变差、生存率偏低等特征。具体表现为,患者肿瘤仍在不断恶化,特别是腹腔内的大量腹水严重影响其生活质量。
从患者的各项检查报告显示,针对这类情况,目前国内尚无有效的治疗方法。而朱棣团队历时近 5 年,针对一个重要癌症靶点,构建了强效和特异的 CAR-T 细胞免疫治疗方案。
以一名胃癌早期患者为例,其腹腔内有大量腹水,经过住院 28 天的密切临床观察治疗和药物治疗后,腹腔脏器内遗留的肝硬化腹水现象,基本全部消失。其肿瘤指标 CA125,均比停止治疗一年前大约下降一半。而且在手术之后,患者的化验血常规、肝功能检查等指标,也均恢复到临床正常指标范围之内。经过三年随访的观察,以及第一临床阶段的药物治疗,患者的恢复程度远超预期。
近年来,免疫细胞的新技术不断涌现,比如新型 CAR-T 和 TCR-T 免疫细胞,在血液瘤中已经取得一定疗效。但是,对实体瘤患者的治疗作用不显著。因此,亟需研发出能突破复杂肿瘤免疫微环境的结肠癌药物。朱棣称:“我们长期致力于肿瘤免疫新疗法的开发,目前已开展三个肿瘤免疫新型药物开发,已经有两项进入临床。其中一个调节肿瘤微环境的重要手段,正是 RORγt 激动剂。”
对于本次研究成果,他很期待最终的药物分子能尽早进入临床。目前,朱棣团队和王永辉团队正对 RORγt 激动剂的临床候选分子用于癌症免疫治疗进行系统的临床前申报研究,目前肿瘤免疫药理学研究和 GLP 毒理已经完成。
-End-
参考:
1、Xia, L., Tian, E., Yu, M. et al. RORγt agonist enhances anti-PD-1 therapy by pro moting monocyte-derived dendritic cells through CXCL10 in cancers. J Exp Clin Cancer Res 41, 155 (2022). https://doi.org/10.1186/s13046-022-02289-2
2、Tian E, Yu M, Feng M, Wang Y, Xie Q*, Zhu D*. RORγt agonist synergizes with CTLA-4 antibody to inhibit tumor growth through inhibition of Treg cells via TGF-β signaling in cancer. Pharmacological Research, 2021. , 172:105793. https://doi.org/10.1016/j.phrs.2021.105793




 个人中心
个人中心
 我是园区
我是园区




