一、概述
新疫苗的商业化生产是一个复杂且花费极大的过程。新疫苗证书的批准需要基于安全性和有效性(通过临床验证)的实验,同时还需要具备可商业化生产的能力(即通过工艺开发和验证)。传统的疫苗生产和产品放行包括以下步骤:
1) 培养工艺:通过发酵或者细胞培养选择合适的培养基培养细菌/病毒种子/细胞来收获目的抗原。
2) 灭活:一般采用化学物质(如,甲醛)或加热(如 65℃)的方式灭活收获液中的病原体。
3) 收获:去除收获液中细胞及细胞碎片。抗原通过过滤和/或离心分离细胞。
4) 纯化:通过超滤,层析等方法去除收获液中的杂质。抗原同样会在纯化工艺中进行浓缩。
5) 脱毒作用:抑制病原,同时保留免疫原性。
6) 原料药:收获需要的抗原并在控制温度条件下保存以备后续使用。
7) 制剂:目标抗原与辅料混合形成最终制剂。
8) 灌装工艺:最终制剂在无菌条件下通过自动灌装机灌入玻璃瓶或预灌封注射器或其他包装容器中。
9) 外包装:灌装后的小瓶或预灌封注射器进行第二级包装,便于日后的储存及运输。
10) QC测试:QC实验室负责中间体和最终产品的质量控制测试。
11) QA放行:质量保证部门确认产品生产完成并按照批准的质量标准和流程进行后才可放行。
12) 临床测试的最终放行:在EU范围内,针对临床测试的实施,需要质量授权人(QP)放行最终用于临床实验的产品。
13) 上市销售的放行:针对商业化的疫苗产品,许多国家,如美国,欧盟和中国,要求国家监管机构(NRA)放行才可进入市场销售疫苗产品。
14) 产品运输:大多数疫苗现在是冷链储存运输,一般是2-8℃,少部分产品在-60℃以下运输。
15) 产品监测:产品放行后进入市场,产品需要进行不良反应(SAEs)安全性监控,跟踪并反馈给厂家和国家监管机构。
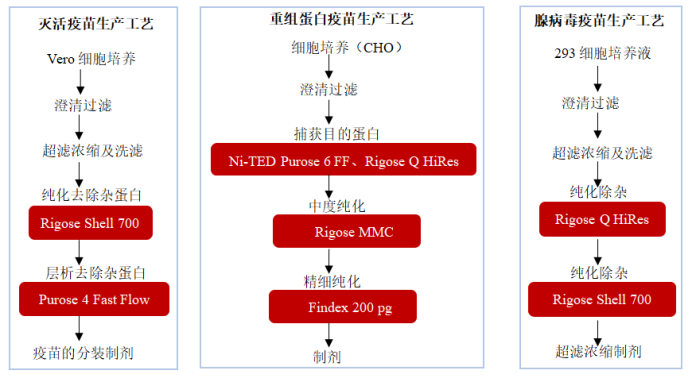
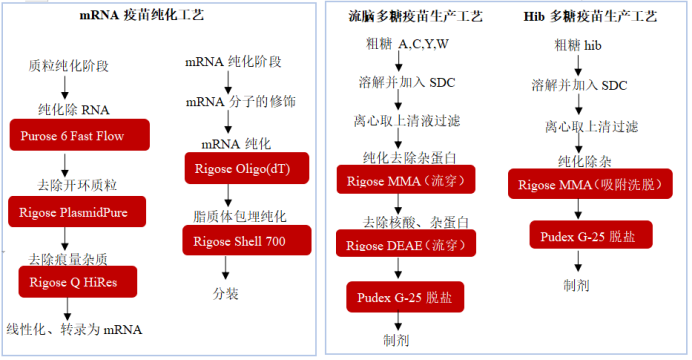
二、人用疫苗生产工艺汇总
现代科学家根据技术路线的不同将人用疫苗分为灭活疫苗、核酸疫苗(DNA和RNA疫苗)、重组蛋白疫苗、多糖疫苗、病毒载体疫苗;基因治疗是指用正常或野生的基因置换致病基因的治疗方法,这一过程需要利用载体将起治疗作用的基因导入靶细胞使其与宿主染色体整合为一体或在宿主细胞中表达从而起到治疗作用,常用载体有腺病毒载体AdV,腺相关病毒载体AAV,慢病毒载体LV等。

三、疫苗原液生产工艺流程概述(以流感疫苗为例)
流感疫苗目前主要还是采用鸡胚(鸡的胚胎)生产,已有超过70年历史,在灭活流感疫苗中,采用鸡胚法生产的疫苗市场份额占到85-90%,而基于细胞法生产的仅为10-15%。但该技术仍存在诸多缺点:需要确保无特定病原体SPF鸡蛋的充足供应,对大规模生产形成了挑战;鸡胚个体差异性大,导致不同批次的疫苗免疫效果存在差异;部分人群对鸡胚蛋白过敏。此外,鸡胚生产法中一个关键的问题是在鸡胚生产的流感疫苗容易导致与流行分离株抗原发生错配。



 个人中心
个人中心
 我是园区
我是园区





