7 月 7 日,武田制药宣布,其肺癌领域一类创新药物 mobocertinib(TAK-788)上市申请(NDA)正式获 CDE 受理,并获准纳入优先审评审批程序,拟用于治疗携带表皮生长因子受体(EGFR)20 号外显子插入突变的非小细胞肺癌(NSCLC)成人患者。
Mobocertinib 是武田研发的一种新型、高选择性的 first-in-class 口服酪氨酸激酶抑制剂(TKI),专门设计用于选择性靶向 EGFR 外显子 20 插入突变。其在美国 NDA 于 2021 年 4 月获得 FDA 授予优先审评资格,此次在中国的上市许可申请获得受理首次实现了中国与全球的同步递交,将助力加速武田创新药早日惠及中国患者。
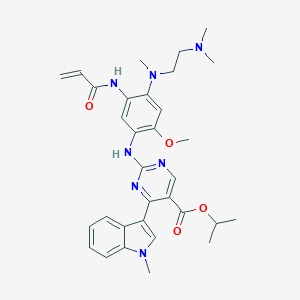
Mobocertinib 结构式,图片来源:pubchem
此次 NDA 是基于一项国际多中心 1/2 期临床研究结果,该研究旨在评估口服 mobocertinib 在包括携带 EGFR 20 号外显子插入突变在内的 NSCLC 患者中的安全性、药代动力学及疗效。临床研究结果表明 mobocertinib 在既往接受过含铂化疗的 EGFR 20 号外显子插入突变的 NSCLC 患者中显示了具有临床意义的缓解,且缓解持续时间可长达 17.5 个月(独立审查委员会评估)。
Mobocertinib 于 2019 年 12 月获得美国食品药品监督管理局(FDA)孤儿药认定;2020 年 4 月,获得 FDA 的突破性治疗认定;2020 年 10 月,mobocertinib 在中国获得「突破性治疗」认定。
EGFR 20 号外显子插入突变是非小细胞肺癌(NSCLC)中的一种罕见突变,在中国,EGFR 20 号外显子插入突变发生率约占所有 NSCLC 的 2.3%。由于目前市场上尚无批准的针对 EGFR 20 号外显子插入突变的靶向药物,而且已上市的一代、二代、三代 EGFR TKI 和化疗对这些患者的益处有限,这部分患者存在非常迫切的临床需求。
Mobocertinib 的临床研究结果令人鼓舞,期待能够尽快获得监管部门批准,为这类患者带来新的治疗选择。
诚心合作,非诚勿扰
PR 稿对接:请加微信 insightxb
投稿:微信 insightxb;邮箱 insight@dxy.cn





 个人中心
个人中心
 我是园区
我是园区




