
作者:植德生命科学组 唐华东 王向雨 冉晶 李丹
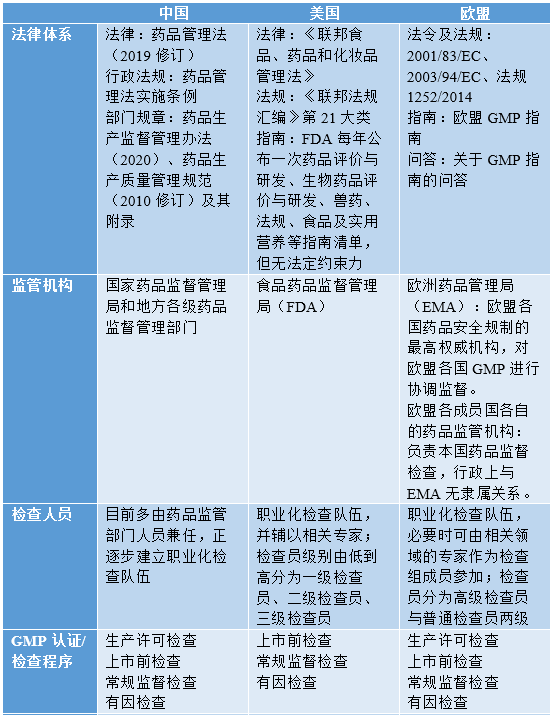

一、药品GMP监管体系
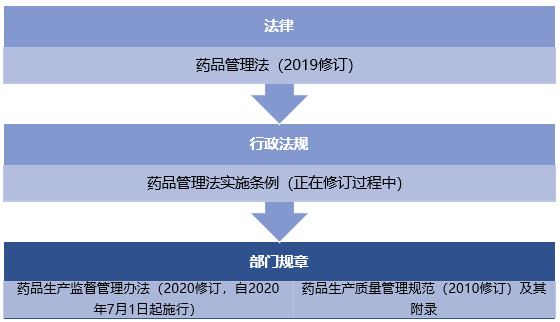
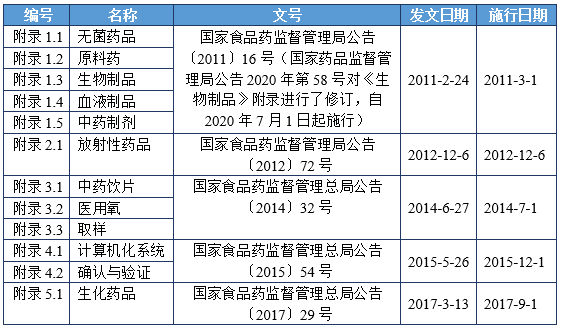
(一)中国
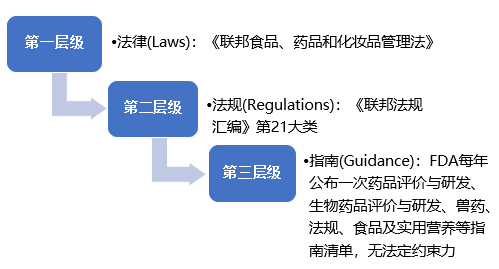
(二)美国
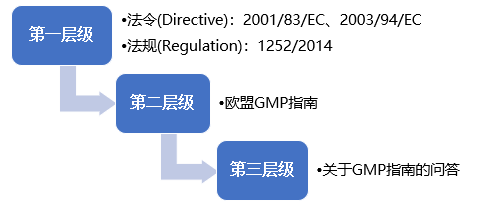
(三)欧盟

(一)监管机构
01
中国
02
美国
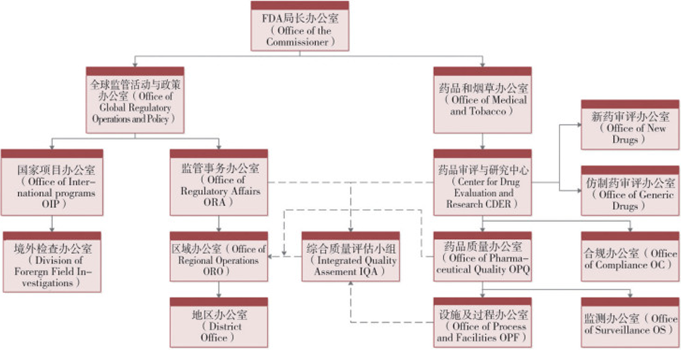
(1) 最高管理层
即ORA区域管理局现场检查处,负责GMP检查工作的宏观统筹,承担法律法规制定、监督管理、对外交流、统一协调等职责。
(2) 中间管理层
即5个区域办公室(Regional Offices),分担区域管理局的现场检查处的部分职责,统一协调辖区内的现成检查工作。管理辖区内的地方办事处,承担辖区内食品药品监管工作,承担与现场检查相关的人员培训、专家管理、任务分派等任务,但不具体参与地方办事处的现场检查工作。
(3) 作业管理层
即20个地区办公室(District Offices)、若干海外办公室、百余个地方检查站,承担具体的现场检查任务。
03
欧盟
(二)人员
三、GMP认证/检查程序
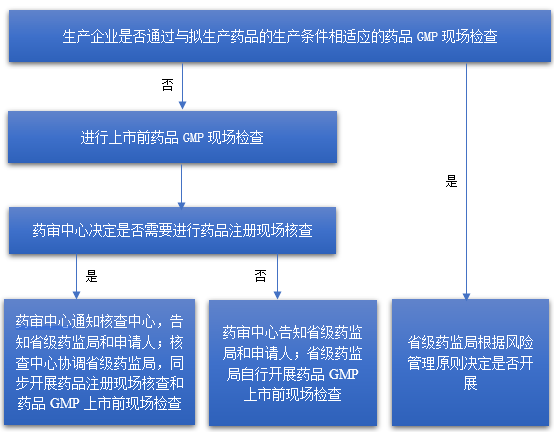
(一)我国
(二)美国
483表格
483表格用于FDA检查员记录其所发现的缺陷。检查员会在检查结束时签发该表格,受检企业则需要在15个工作日内对其中缺陷进行正式回复。
EIR
除了483表以外,检查员还要制作EIR。EIR要在30个工作日内完成,然后交由FDA地区办公室或中央办公室负责人检查,检查后会被识别为以下几种状态[15]:
NAI:不需要采取措施,即在检查期间没有发现违规事项,或者发现的违规事项不足以证明采取进一步的监管措施是合理的;
VAI:自愿采取措施——发现了违规事项,但ORA不建议任何行政或监管措施;
OAI:官方需采取行动——发现违规项目,需要采取进一步法规措施(例如警告信)。
警告信
警告信是FDA对企业存在严重违规行为的劝告性通知[16],FDA在官网公布警告信,是对现场检查中发现违规行为的主要监管措施。对于批准前检查,当企业未通过批准前检查时,FDA通常不会发出警告信;但是如果被查企业已有产品在美国上市,FDA将会对在美国已上市的药品发出警告信。2019年10月1日,上海医药工业研究院拒绝了FDA监督检查和批准前检查,CDER向其发出警告信,并在信中指出CDER可能发出建议,不予批准将上海医药工业研究院列为药品制造商相关的任何申请或补充申请。
(三)欧洲
01
生产许可证及GMP检查
02
上市许可证及前置GMP检查
结语
参考文献
[1]国内外药品GMP对比调研报告(二).中国药事,2008(11):1016-1021.
[2]https://www.fda.gov/regulatory-information/search-fda-guidance-documents/
[3]刘禹.中美药品GMP比较研究.医药工程设计,2007(06):43-46.
[4]https://www.ema.europa.eu/en/human-regulatory/research-development/compliance/good-manufacturing-practice
[5]杨牧,王晓,赵红菊.美国FDA药品监管体系发展分析.中国药事,2019,33(3): 337-343.
[6]同上
[7]薛娇,国内外药品GMP监管体系对比分析.中国药师,2015,18(07):1199-1202.
[8]《药品注册管理办法》(2020)第四十七条
[9]《药品生产监督管理办法》(2020)第五十二条
[10]同注释5
[11]邱琼. FDA监管检查体系改革调整新动态.国际药品检查动态研究,2017,2(1):10-11.
[12] CPGM 7356-002 Drug Manufacturing Inspections
[13] CPGM 7346-832 Pre-ApprovalInspections/Investigations
[14] CPGM 7356-843 Post-Approval Audit Inspections
[15]https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/inspection-references/inspections-database-frequently-asked-questions#classification
[16]宋华琳,刘炫.美国FDA警告信的制度架构及启示.中国食品药品监管,2019(12):28-35.
[17]https://www.gmp-compliance.org/gmp-news/fda-inspection-reports-what-is-what
[18]https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/compliance-actions-and-activities/fda-debarment-list-drug-product-applications
[19]https://www.ema.europa.eu/en/human-regulatory/overview/compliance-overview
[20]https://www.ema.europa.eu/en/human-regulatory/marketing-authorisation/pre-authorisation-guidance
[21]http://eudragmdp.ema.europa.eu/inspections/gmpc/index.do
植德生命科学组

相关阅读




 个人中心
个人中心
 我是园区
我是园区




