3 月 24 日,国家药监局正式批准普吉华®(普拉替尼胶囊)作为国家一类新药上市申请,用于既往接受过含铂化疗的转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。
Pralsetinib 是一种口服(每日一次)、高效和高选择性的靶向致癌性 RET 变异的药物。目前已在美国 获批分别用于治疗转移性 RET 融合阳性 NSCLC 的成人患者、晚期或转移性 RET 突变甲状腺髓样癌成人和 12 岁及以上儿童患者,以及晚期或转移性 RET 融合阳性甲状腺癌成人和 12 岁及以上儿童患者。
一项全球 I/II 期 ARROW 关键性试验的中国患者研究数据显示,普拉替尼在经含铂化疗的 RET 融合阳性的 NSCLC 中国患者中显示出了优越和持久的抗肿瘤活性,总体缓解率 (ORR) 为 56%,中位缓解持续时间(DOR)未达到,6 个月的 DOR 率为 83%,安全性及耐受性良好,未出现与普拉替尼相关的不良事件导致的终止治疗或死亡。
本次普吉华®成功获批,标志着中国第一个选择性 RET 抑制剂的获批上市,同时基石药业也迎来了首个商业化上市的产品。
基石药业在就开始积极准备新品上市后的商业化布局,在今年 3 月 5 日,基石药业与国药控股达成合作,通过各自在医药创新、市场开拓与渠道管理方面的优势,携手推进精准治疗药物阿伐替尼 (Avapritnib) 和普拉替尼 (Pralsetinib) 在中国获批上市后的商业化进程。
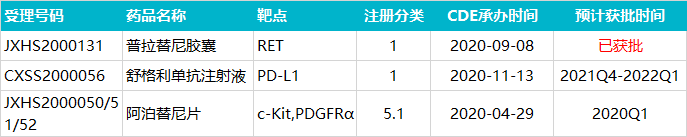
除了已获批的首款商业化产品「普拉替尼胶囊」外,基石药业目前还 3 款新药处于上市申请中,分别为阿伐替尼、艾伏尼布及 PD-L1 舒格利单抗。
舒格利单抗,有望成为首个国产 PD-L1 单抗药物
舒格利单抗是基石药业开发的一款全人源、全长抗 PD-L1 单克隆抗体,舒格利单抗与天然的 G 型 IgG4 人抗体相似,可降低患者的免疫原性及毒性风险,与同类药物相比具有潜在的独特优势及显著的差异性。
2
020 年11 月,基石药业在国内递交舒格利单抗新药上市申请(NDA),用于联合化疗一线治疗晚期鳞状和非鳞状非小细胞肺癌(NSCLC)患者。值得注意的是,这是首个报上市的国产 PD-L1 单抗药物,如果进展顺利,今年有望获批成为首个国产 PD-L1 单抗药物。
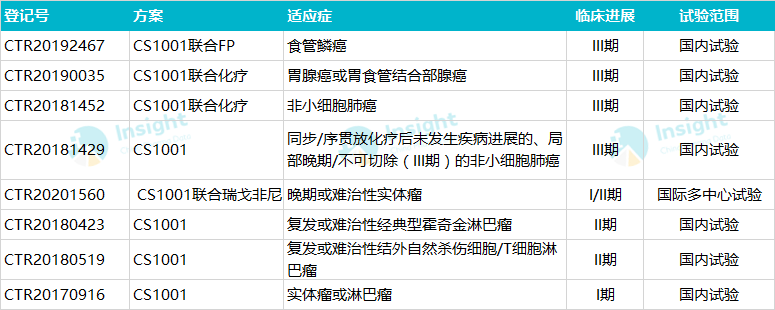
据 Insight 数据库显示,目前舒格利单抗还有多个注册性临床试验正在开展,适应症涉及食管癌、胃腺癌或胃食管结合部腺癌、霍奇金淋巴瘤等。
为补充肿瘤免疫治疗骨干候选药物,基石药业积极开展合作引进,新药管线布局丰富且快速。
从 Agios 取得 Ivosidenib (CS3010) 在大中华地区开发及商业化独家许可权。从 Blueprint Medicines 取得 Avapritinib(CS3007)、Pralsetinib (CS3009)及 Fisogatinib (CS3008) 在大中华地区开发及商业化的独家许可权。
依据各自全球临床试验所取得的数据,上述四种候选药物的主要适应症均已取得概念性验证。
阿伐替尼(Avapritinib):高选择性 KIT/PDGFRA 抑制剂
阿伐替尼是一款高选择性口服 KIT 和 PDGFRα 抑制剂,基石药业在 2018 年 6 月从 Blueprint Medicines 独家授权引进,2020 年 4 月在国内递交上市申请,7 月以符合附条件批准被纳入优先审评,目前处于在审批状态,预计近日获批,适应症为用于治疗携带血小板衍生生长因子受体α(PDGFRA)外显子18突变(包括PDGFRA D842V突变)的不可切除或转移性胃肠道间质瘤(GIST)成人患者。
阿伐替尼在 2020 年 已先后获美国 FDA 和欧洲 EMA 批准上市,用于治疗携带 PDGFRA 基因 18 号外显子突变(包括 PDGFRA D842V 突变)的不可切除性或转移性 GIST 成人患者。
在 2020 年 CSCO 年会上,基石药业公布了阿泊替尼片(Avapritinib)在中国 I/II 期桥接研究取得的积极结果。此项桥接研究是一项开放标签、多中心的 I/II 期临床研究,旨在评估阿泊替尼治疗不可切除或转移性晚期 GIST 患者的安全性、药代动力学特征和抗肿瘤疗效。
结果显示,阿泊替尼在携带 PDGFRA D842V 突变的患者中显示出显著的抗肿瘤活性。8 例携带 PDGFRA D842V 突变的患者中,所有患者靶病灶均有缩小,有 5 例患者达到了研究者评估的部分缓解,总体缓解率(ORR)为 62.5%,另 3 例患者的研究者评估结果为疾病稳定。在至少接受过 3 线既往治疗的(4L+)GIST 患者中阿泊替尼也显示出一定的疗效,研究者评估的 ORR 为 26.1%。
艾伏尼布是全球首创的有效、选择性口服突变型IDH1(IDH1m+)抑制剂,2018 年基石药业从 Agios 独家授权引进。在 2018 年和 2019 年该药先后获 FDA 批准用于用于治疗复发性或难治性(R/R) IDH1m+急性髓系白血病(AML)及一线治疗新诊断的IDH1m+急性髓系白血病(AML)。
目前,基石药业已在台湾和新加坡递交上市申请,预计今年获批。在国内,艾伏尼布已经于 2019 年启动一项 III 期临床,联合阿扎胞苷治疗 IDH1 突变的急性髓性白血病。
基石药业拥有一条健康又富有竞争力的管线,确保公司能有源源不断的新产品问世。
除了上述已经报产的产品外,处于关键性临床阶段的还有 PD-1 单抗 CS1003,其联合仑伐替尼对比仑伐替尼治疗肝细胞癌的 III 期研究正在进行中。
根据官网显示,目前基石药业拥有14 款在研产品,其中 8 款为自主研发,6 款为授权引进。除了上述临床后期阶段的多款产品外,在早期临床阶段的候选药物布局也较为丰富,不仅有小分子药物、单抗,还有多特异性抗体药物。
Fisogatinib(CS3008,FGFR4 抑制剂):
Fisogatinib 是一款口服的、高选择性、不可逆的 FGFR4 抑制剂,由 Blueprint Medicines 公司开发,可高特异性抑制 FGFR4,从而避免对 FGFR1,FGFR2 和 FGFR3 的作用。临床前数据表明,FGFR4 是部分晚期 HCC 患者的致癌驱动因子,因此该药是治疗 HCC 患者极具潜力的新药。
当前,根据 Insight 数据库,国内 FGFR4 抑制剂尚属于早期研发阶段,以基石药业的 Fisogatinib 和诺华制药的 Roblitinib 进展最快,处于 2 期临床;北京天诚医药和浙江海正药业处于 1 期临床;另有上海和誉和贝达药业已获批临床。
CS1002 是基石药业自主研发的抗 CTLA-4 单抗,属于伊匹木单抗生物类似药。2019 年,该药首次启动临床试验,当前正处于 I 期临床阶段。Insight 数据库显示,目前国内尚无伊匹木单抗生物类似药上市,3 家生物类似药处于临床开发阶段,以信达最快,已处于 III 期临床,基石药业和上海博威生物均处于临床 I 期。
CS3002 是由基石药业开发的 CDK4/6 选择性抑制剂,可通过特异性抑制 CDK4/6 激酶的活性,达到抑制肿瘤生长的目的。2019 年 8 月,CS3002 已在澳大利亚获得批准开展一项开放性、多剂量、剂量递增与剂量扩展的 1 期研究,评价 CS3002 在晚期实体瘤患者中的安全性、耐受性、药代动力学及抗肿瘤疗效。目前国内已批准临床。
CS3005 是由基石药业开发的腺苷 A2a 受体拮抗剂,是一种肿瘤免疫微环境调节剂,通过阻断腺苷和其腺苷 A2a 受体的结合,从而逆转腺苷的免疫抑制作用,激活免疫反应并提高对免疫检查点抑制剂的响应率。目前国内已批准临床。
NM21-1480(PD-L1×4-1BB×HSA 三特异性分子):
NM21-1480(ND021)是一种针对 3 个靶点的特异性抗体片段分子,可以同时结合 PD-L1 与 4-1BB,并且还可以结合人血清白蛋白(HSA),在分子设计和理念上与其他 PD-L1/4-1BB 双抗药物有很大不同,是一个精致的分子设计,有可能因为更广的适应症、更大的获益人群、更友好的服药模式/频率和安全性而取代目前 PD-(L)1 疗法成为下一代同类最佳的肿瘤免疫疗法。
基石药业正在从临床研发阶段加速迈进商业化,而针对不同的产品,基石药业选择了不同的商业化策略,确保产品上市后快速推到市场。
2020 年 9 月 30 日与辉瑞签订的合作除投资外的另一个重点是,基石药业以最高 2.8 亿美元的价格将舒格利单抗的中国大陆的商业化权利授予辉瑞。
显然,在中国市场日趋激烈的 PD-1/PD-L1 竞争中,基石药业选择借力具有成熟商业化经验的辉瑞,以期在未来竞争中快速占领市场。
2020 年 10 月 27 日,基石药业与美国 EQRx 公司达成累计高达 13 亿美元的战略合作,将舒格利单抗、CS1003 在大中华区以外地区开发及商业化权利授予 EQRx 公司。
凭借 EQRx 独特的综合能力可以确保舒格利单抗以及 CS1003 在国际市场商业化的顺利落地,并且最大化其在全球市场的潜力。
对于基石药业来说,借力国际合作伙伴,不仅能够使得产品的商业化事半功倍,大幅提升市场渗透率,同时,也为其公司在关键战略发展领域的投资提供了即时资金支持,有利于其重新分配资源来开发新药管线。
公开信息显示,基石药业早已开始备战商业化,目前基石药业目前已经建立了一支接近 200 人的商业团队, 其中管理人员有着超 15 年以上的肿瘤领域经验,均在业内有丰富的肿瘤产品成功上市经验。
基石药业期望在未来的 3-5 年当中,成功打造一支专业化的商业化团队,从而将基石药业建设成为全方位的生物制药公司。
PR 稿对接:请加微信 insightxb
投稿:微信 insightxb;邮箱 insight@dxy.cn
数据库合作:请加微信 yiyaoshujuku001
微信申请试用数据库 30 天









 个人中心
个人中心
 我是园区
我是园区




