Nat Cell Biol | 生物大数据分析揭示全新的基因调控模式和潜在的抗癌药物靶点
收藏
关键词:
抗癌基因靶点药物揭示生物药CellNat癌
资讯来源:BioArt + 订阅账号
发布时间:
2022-05-29

责编 | 兮
在生物体内,绝大部分基因需要先转录成信使核糖核酸(mRNA),进而再翻译成蛋白质来行使功能。真核生物中的mRNA不但有能够编码蛋白的部分,也包含两段非翻译的区域(UTR)。它们分别位于5’端从mRNA头部到翻译起始密码子,以及3’端从终止密码子到mRNA 的尾部。在高等生物中,整个转录和翻译过程都存在非常复杂的调控模式,其中最重要的一种调控模式之一就是mRNA的剪接(splicing)。它会将刚转录出来的mRNA前体切割成两种不同类型的小片段,包括外显子和内含子,然后再将不同的外显子片段拼接起来
(https://baike.baidu.com/item/RNA剪接/1618134)
。在人的基因组中,超过95%的基因都有着不同的剪接模式,而异常的剪接会影响各种疾病的产生和发展,这其中就包括癌症。
2022年5月26日,新加坡癌症科学研究所
(CSI)
的Yvonne Tay课题组与沙特阿卜杜拉国王科技大学
(KAUST)
高欣课题组合作,并联合新加坡基因组研究所
(GIS)
,新加坡国立大学
(NUS)
,南洋理工大学
(NTU)
,以及百图生科
(北京)
智能技术有限公司在Nature Cell Biology 发表了文章
Pan-cancer pervasive upregulation of 3′ UTR splicing drives tumourigenesis
。
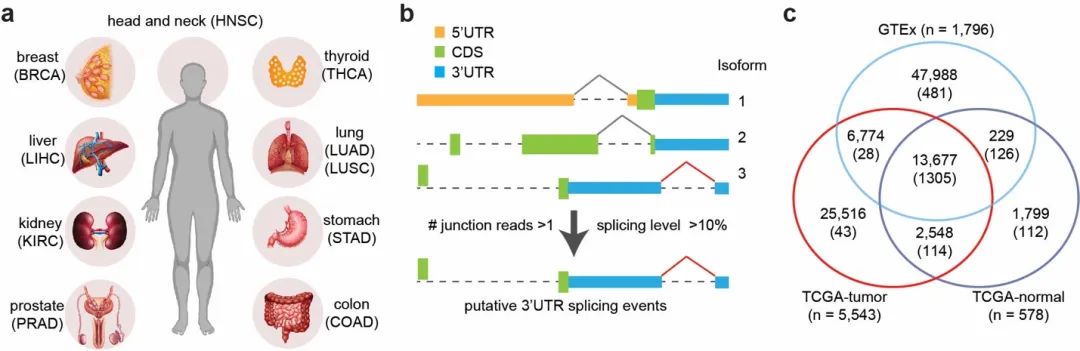
基于对来自10种不同癌症类型,超过8000个转录组测序样本的数据分析,文章揭示了一种以往被忽视的基因调控模式——位于3’端非编码区域的剪接,在癌细胞中普遍存在,并显著上调来驱动肿瘤发生。
通过对这些大批量测序数据的分析,作者们在不同癌症病人样本中鉴定出来大量的3’端非编码区域剪接事件,其中包括超过1000个常见的事件可以在超过半数的病人样本中发现。尤其是在肝细胞癌
(LIHC)
以及结肠癌
(COAD)
病人中,更多的3’端非编码区域的剪接和病人更短的生存时间显著相关。作者们将这超过1000种不同的剪接事件在10种癌症的丰度,以及它们和病人总体生存时间的相关性都收集到一个数据库——SpUR
(https://www.cbrc.kaust.edu.sa/spur/home/)
以供研究人员访问和使用。
通过对这些3’端非编码区域剪接的泛癌症分析,作者们鉴定出来在10种癌症中最显著上调的事件来自于基因CTNNB1。这是一个非常重要的原癌基因,它编码的β-连环蛋白是WNT信号通路中的核心分子
(https://baike.baidu.com/item/wnt信号通路/994227)
。它在肝细胞癌中的突变频率仅次于p53,在所有基因中排第2。超过1/4的肝细胞癌病人都有来自这个基因的突变。在结肠癌中,突变频率最高
(75%的结肠癌病人)
的基因叫APC,而APC的主要功能就是降解CTNNB1产生的β-连环蛋白。
作者们发现用小干扰RNA
(siRNA)
或者反义寡聚核苷酸
(ASO)
分子来阻止CTNNB1的3’端非编码区域的剪接
(si-3’SP)
,可以显著地抑制肿瘤细胞的生长和迁移。尤其是在小鼠动物模型中,抑制CTNNB1的3’端非编码区域的剪接以后,整个肿瘤甚至会完全消失。
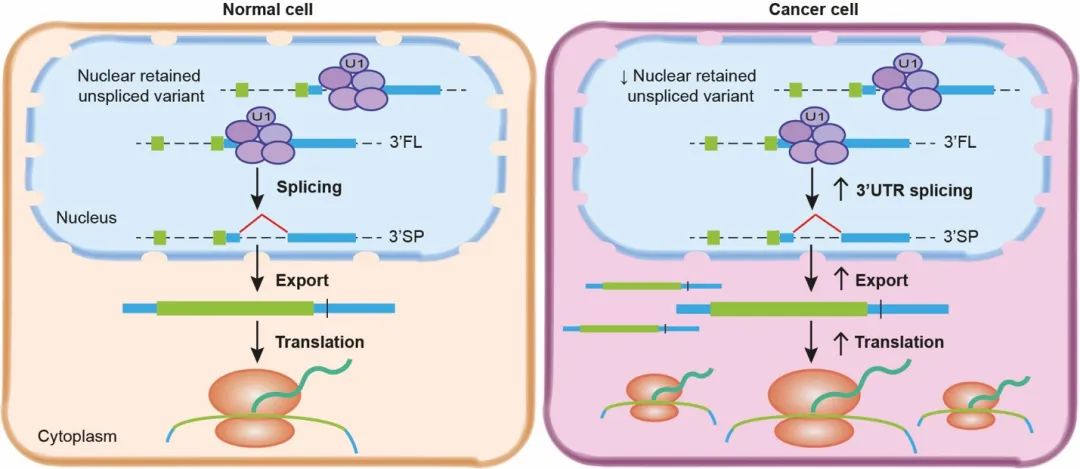
通过一些列的生物化学和细胞生物学实验,作者们最终证明了3’端非编码区域的剪接会促进CTNNB1的mRNA分子从细胞核中转运到细胞质,进而翻译出更多的β-连环蛋白来驱动肿瘤发生。而且CTNNB1并不是特例,这种调控模式在其它基因中比如CHEK1也同样存在。
在这项研究中,作者们
揭
示了一种以往被忽略的基因调控模式——位于mRNA的3’端非编码区域的剪接,广泛存在于癌症细胞中,并显著上调。
这种通过改变非编码区域来促进mRNA转运,进而产生更多蛋白的机制可能在不同类型的癌症细胞中普遍存在。很多癌症可能就是通过这种方式来激活原癌基因和驱动肿瘤发生。
文章鉴定出来在10种癌症中这种模式最显著上调的事件来自一个非常重要的原癌基因——CTNNB1。由于这个基因编码的β-连环蛋白是一个转录因子,通常位于细胞内并且能进入细胞核来调控下游基因,用抗体和小分子来靶向这个蛋白会非常困难,这也导致了目前市场上没有任何药物可以靶向这个蛋白。但是过去几年,有一些制药公司试图开发基于RNA的药物,通过siRNA抑制CTNNB1的 mRNA翻译进而降低β-连环蛋白,取得了一定的进展,有些甚至已经进入临床2期。这篇文章的发现为这些基于RNA的药物开发方案,提供了全新的潜在靶点。通过这个靶点,可能有助于开发出对肿瘤细胞更特异,对正常细胞副作用更小的核酸抗癌药物。
以往的RNA剪接模式研究往往聚集在编码蛋白的序列,而忽视了这种非编码区域的变化。同时由于目前广泛使用的第二代高通量测序需要将长链的核酸分子打断成短的片段,虽然它可以有效的分析mRNA中各个位点的剪接模式,但是对拼装出整体mRNA核酸分子序列始终存在技术性上的困难。所以,成熟的可以测量出全长mRNA分子的第三代测序技术在不久的将来可以大步地促进癌症中RNA异常调控模式的研究。
https://www.nature.com/articles/s41556-022-00913-z
1. J.J. Chan et al. "Pan-cancer pervasive upregulation of 3’UTR splicing drives tumourigenesis.”
Nature Cell Biology
(2022). DOI: 10.1038/s41556-022-00913-z
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。



 药选址
药选址



