
// 导语:
///
今天,罗氏制药正式公布中国国家药品监督管理局(NMPA)批准其肿瘤免疫创新药物阿替利珠单抗(商品名:泰圣奇®,Tecentriq®)联合贝伐珠单抗(以下简称“T+A”联合疗法)用于治疗既往未接受过系统治疗的不可切除肝细胞癌(HCC)患者。此次获批的主要依据是3期临床试验IMbrave150的研究结果,其中包括对194名中国亚群患者的分析。
肝癌治疗现状
毫无疑问,近两年肝癌的药物发展火箭速度,呈现靶向、免疫双向增长。但是两者单药的有效率都不够看。而靶免联合模式的出现,为肝癌治疗开拓了新方向。罗氏的A+T方案、默沙东的可乐组合、恒瑞的双艾组合、信达的 信迪利+IBI305组合先后崛起,开展临床研究。而罗氏成为首个完成III期临床研究并达到阳性结果。在FDA获批并最早获批中国肝癌一线的联合方案!实力稳占肝癌头把交椅。而数据有多强,一起看一下IMbrave150研究结果。
IMbrave150研究结果展示
IMbrave150是一项国际多中心的开放性随机对照的III期临床研究,旨在评估Tecentriq+Avastin对比索拉非尼一线治疗局部晚期、不可切除或转移性HCC的疗效。该研究纳入501例未接受过全身治疗的不可切除HCC患者,以2∶1的比例随机分配接受Tecentriq+Avastin联合治疗或目前的肝癌标准疗法索拉非尼治疗。该试验的共同主要终点是总生存(OS)和根据RECISTv1.1标准中央审查机构(IRF)评估无进展生存(PFS);次要疗效终点包括总缓解率(ORR)、至疾病进展时间(TTP)和缓解持续时间(DOR),以及患者报告的结局(PRO)、安全性和药代动力学。
阿特朱单抗+贝伐朱单抗自2018年曝出后,在多次国际肿瘤大会中持续曝出精彩数据。在近期的2019ESMO大会上就发布了一项Ib期研究GO30140/NCT02715531试验的结果。该研究探索了Tecentriq®(atezolizumab)联合安维汀®(贝伐珠单抗)用于治疗不可切除肝细胞癌(HCC)的疗效和安全性,这些患者此前未接受系统性治疗。HCC是最常见的肝癌类型。
● 研究表明, Tecentriq®与安维汀®联合用药,用于既往未接受系统性治疗的不可切除肝细胞癌患者,确认的客观缓解率达36%,其中CR率为12%。
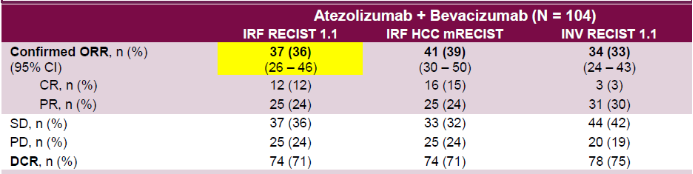
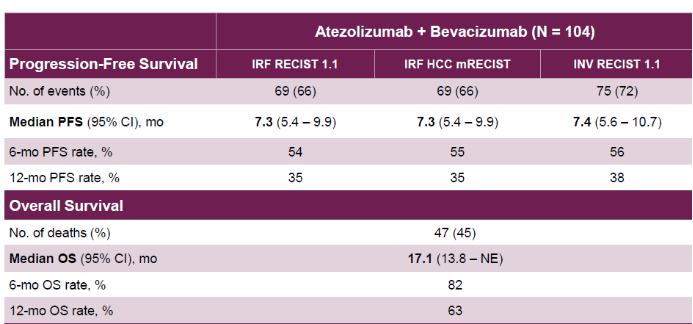
● 关键次要研究终点中位总体生存(OS)达到了17.1个月(未成熟),无进展生存(PFS)为7.3个月。
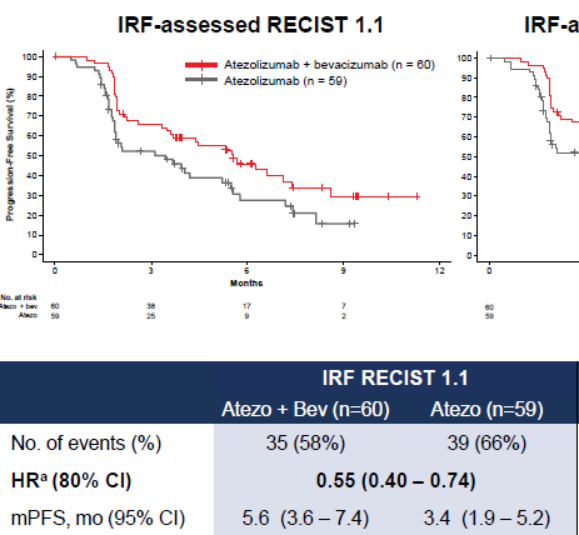
● 相较于Tecentriq®单药治疗,Tecentriq®与安维汀®联合用药使疾病恶化或死亡的风险降低45%。
安全性结果:T+A方案普遍耐受性良好,除阿特珠单抗和贝伐珠单抗的单药已知安全性事件外,没有发现新的安全性问题。3~4级治疗相关不良事件(AE)占39%,最常见的AE为:蛋白尿(37%)、食欲减退(35%)和疲劳(28%)。
基于I期数据,美国食品与药物管理局(FDA)已经授予阿特珠单抗+贝伐珠单抗联合方案用于晚期或转移性HCC一线治疗的突破性疗法认定,因此阿特珠单抗联合贝伐珠单抗也一度成为晚期肝癌一线治疗前景方案。
与上述GO30140研究相比,IMbrave150纳入标准的主要差异是排除了肝功能不足(Child-Pugh评分≥B7)的患者,因为有信息提示,这些患者不会从联合治疗中获益。关于MVI和EHS与GO30140是否有差异,还需要等待IMbrave150的分析结果。
IMbrave150研究的此次双阳成功,强有力证实了免疫+抗血管疗法的成功,对于OS的提升更是十年破冰!目前肝癌的靶向免疫药物众多,但均未在索拉菲尼的基础上延伸OS,以至于多年来一线用药寥寥可数。此次的成功打破晚期肝癌一线治疗的僵局,为包括中国在内的全球晚期肝癌患者在免疫联合治疗中的获益提供有力证据。
参考文献 ●●
1.https://www.roche.com/media/releases/med-cor-2019-10-21.htm
2.https://mp.weixin.qq.com/s/qqdn0B-BFz43ZAZ2Hgv3aA

声明:本资料中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。
本文版权归找药宝典所有,任何个人或机构转载需获得找药宝典授权,在授权范围内使用,并标注来源“找药宝典”。
文章转载、媒体合作请联系小编:p88128812



 个人中心
个人中心
 我是园区
我是园区




