▎药明康德内容团队编辑
2016年12月13日依法创建的再生医学先进疗法(RMAT)资格认定,经过近4年发展,即将步入开花结果的季节。
再生医学先进疗法资格认定(Regenerative Medicine Advanced Therapy Designation,RMAT资格认定)依据2016年12月13日经签署生效的《21世纪治愈法案》(the 21st Century Cures Act)第3033节创建。旨在加快用于严重病症的再生医学疗法的开发。FDA授予RMAT资格认定的条件是,有初步的临床证据表明,有潜力解决针对相关病症的未竟医疗需求。再生医学先进疗法资格认定,包括快速通道与突破性疗法认定的所有优惠措施,包括与FDA的早期互动,加快产品开发,以及优先审评或加速批准的考量。授予RMAT资格认定,还意味着可以提高临床试验设计灵活性,例如在临床试验场所数量方面。此外,在批准后研究中,开发机构还可以采用患者注册数据与其它的现实世界数据源。RMAT资格认定涉及范围,包括拟用于治疗、改变、逆转或治愈严重或致命疾病或症状的细胞、基因疗法、治疗性组织工程产品、人体细胞与组织产品,或使用此类疗法或产品的任何组合产品;但不包括公众健康服务法案第361节与联邦法规汇编第21编第1271部所规定的产品。
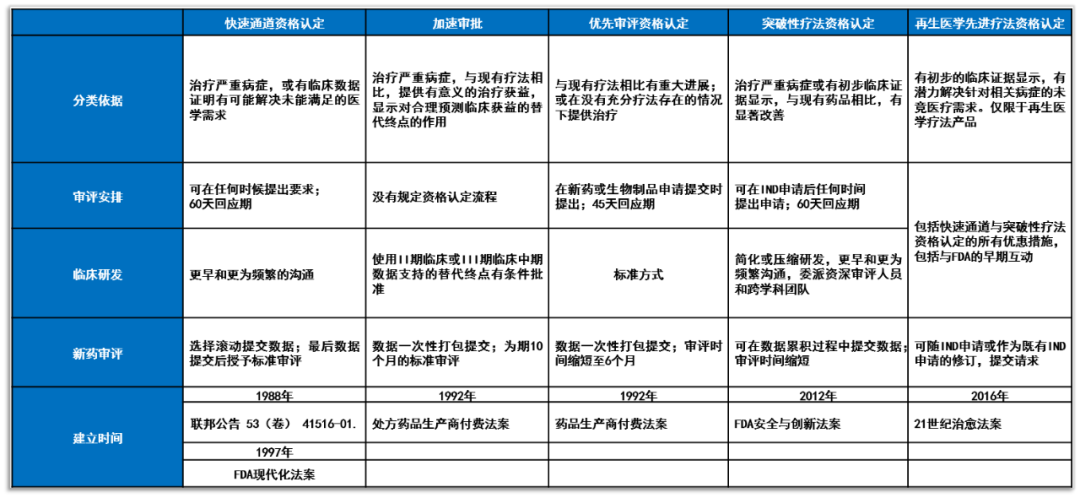
▲表1. 通过立法建立的加快审评审批计划(数据来源:参考资料[11, 12],药明康德内容团队制图)
迄今为止,RMAT资格认定的具体实施情况,备受业界与利益攸关关注。尽管寻求突破性疗法认定的申办方,必须证明相关的候选治疗药物比现有治疗药物有实质性的改善,但RMAT资格认定仅要求相关疗法具有解决未竟医疗需求的潜力。因此,RMAT资格认定为相关领域的开发机构提供了更大的灵活性,进一步推动创新。再生医学先进疗法领域的发展,为患有严重疾病与障碍的患者带来了深远、持久,甚至可能治愈的获益前景;而RMAT资格认定的具体实施,助力推动将这些具有革命性的技术进入市场。在自RMAT资格认定创建以来,FDA已经授予超过50个针对相关技术与适应症的RMAT资格认定。在与美国国会、FDA以及其它利益攸关方的合作中,再生医学联盟(The Alliance for Regenerative Medicine, ARM)及其成员组织发挥了重要作用,通过相关各方的共同努力,为再生医学先进疗法创建了新的监管路径。

▲再生医学联盟(The Alliance for Regenerative Medicine,ARM)标识. (图片来源:ARM官网)
再生医学的价值,获得越来越多的监管机构认可。近年来,其它国家的监管机构,也制定了具体的监管规定。2013年5月10日,日本国会通过《再生医疗促进法》(Regeneration Medicine Promotion Law)之后,2015年,厚生劳动省(MHLW)公布“SAKIGAKE战略”,旨在促进再生药物、其它创新药物与医疗器械的研发。“SAKIGAKE战略”涵盖从基础研究到临床研究/试验、审评审批、安全措施、保险覆盖、基础设施改善、市场拓展等领域。“SAKIGAKE战略”的核心,是SAKIGAKE资格认定体系与加快批准。欧盟、韩国、中国台湾地区等也相继出台了相关政策。RMAT资格认定于2016年12月13日《21世纪治愈法案》正式生效之时创建,与“SAKIGAKE战略”相比,出台时间相对较晚,但在提交资格认定的申办方数量与属于RMAT资格认定数量方面,FDA的RMAT资格认定均处于领先地位。除了助力行业发展之外,RMAT资格认定还有助于解决对再生医学疗法产品的需求。
表2概述了RMAT资格认定生效以来的具体实施情况。其中,2017年的数字,只包括RMAT资格认定开始后的9个月的数字;今年的数字,只包括今年前半年的数字。今年头6个月的资格认定请求已经达到31项,增长势头强劲。今年以来,FDA调整力量,全力应对COVID-19大流行,但今年以来授予RMAT资格认定数量与其它年份相当。应对COVID-19大流行对RMAT资格认定时间的影响,目前尚未知晓。
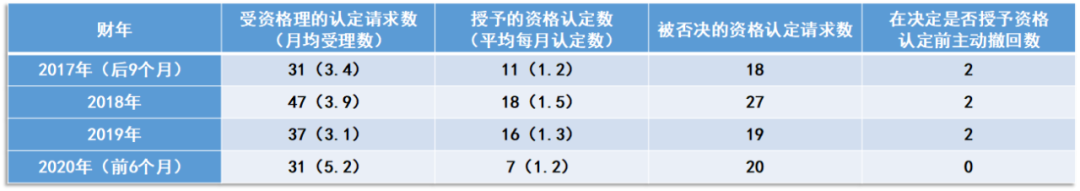
▲表2. 按财年划分的RMAT资格认定请求情况(数据来源:参考资料[8] ,药明康德内容团队制图)
尽管迄今为止,尚未有RMAT资格认定产品获得上市批准,但预计近期FDA将会就几个获得RMAT资格认定的候选治疗产品做出决定。近期将做出监管决定的几个RMAT产品,包括用于治疗小儿先天性无胸腺症的RVT-802;治疗复发或难治性大b细胞淋巴瘤的Liso-cel;以及用于治疗严重热灼伤的StrataGraft。到目前为止,没有出现FDA授予RMAT资格认定后被撤回或撤销的情况。
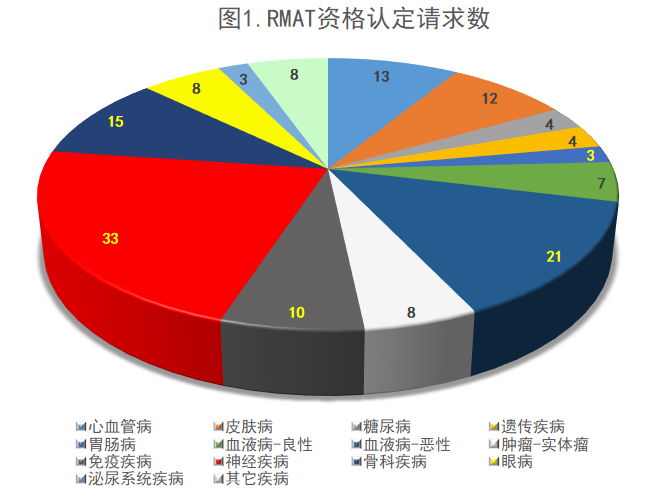
下图为到今年7月9日为止的RMAT资格认定请求情况。RMAT资格认定请求最多的为神经疾病治疗领域(33项请求),其次为肿瘤治疗领域(28项)、骨科疾病(15项)、心血管疾病(13项)与皮肤病治疗领域(12项)。
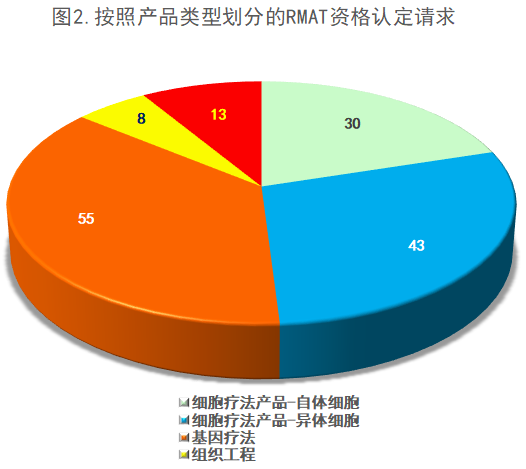
下图为到今年7月9日为止,按照产品类型划分的RMAT资格认定情况。资格认定请求最多的为细胞疗法产品(73项),包括异体产品(43项)和自体产品(30项)。基因疗法产品(55项)也占了这些需求的很大一部分。
截止于今年6月30日,FDA共授予52项RMAT资格认定,其中公布44项。
表3~表6为2017-2020年6月30日公布的RMAT资格认定列表。
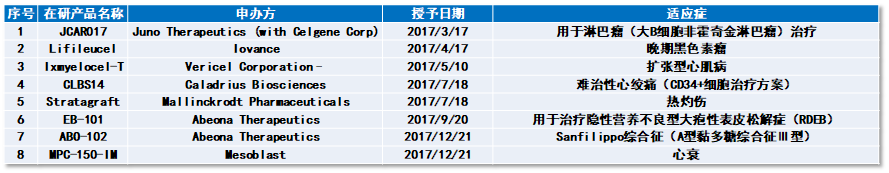
▲表3. 2017年公布的RMAT资格认定(按授予日期先后排序,数据来源:参考资料[6],药明康德内容团队制表)

▲表4. 2018年公布的RMAT资格认定(按授予日期先后排序,数据来源:参考资料[6],药明康德内容团队制表)

▲表5. 2019年公布的RMAT资格认定(按授予日期先后排序,数据来源:参考资料[6],药明康德内容团队制表)

▲表6. 2020年公布的RMAT资格认定(截止于2020年6月30日)(按授予日期先后排序,数据来源:参考资料[6],药明康德内容团队制表)
RMAT资格认定成为各界关注的热点。随着RVT-802、Liso-cel、StrataGraft是否能够获批,将于近期揭晓,标志着RMAT计划开始步入开花结果的季节。
免责声明:本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。
参考资料:
[1] MHLW. Strategy of SAKIGAKE. Jun 17, 2014. Retrieved Jul 16, 2020 from https://www.mhlw.go.jp/english/policy/health-medical/pharmaceuticals/dl/140729-01-01.pdf
[2] Ken Sakushima. Regulatory Trends Regenerative Medicine in Japan. Mar 15, 2017. Retrieved Jul 16, 2020 from https://www.pmda.go.jp/files/000226750.pdf
[3] EMA. Guidelines relevant for advanced therapy medicinal products. Retrieved Jul 16, 2020 from https://www.ema.europa.eu/en/human-regulatory/research-development/advanced-therapies/guidelines-relevant-advanced-therapy-medicinal-products
[4] 杨青玲. 台、日、韩之细胞治疗产品法规概论. 当代医药法规月刊. Sept 5, 2016,v71,p8-22
[5] FDA. Cumulative CBER Regenerative Medicine Advanced Therapy (RMAT) Designation Requests Received by Fiscal Year. Jul 9, 2020. Retrieved Jul 17, 2020 from https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/cumulative-cber-regenerative-medicine-advanced-therapy-rmat-designation-requests-received-fiscal
[6] Cade Hildreth. What Is An RMAT? List of RMAT Designations (44). May 12, 2020. Retrieved Jul 17, 2020 from https://bioinformant.com/rmat/
[7] Niche. Knoepfler Lab Stem Cell Blog. RMAT List (44). Jul 10, 2020. Retrieved Jul 17, 2020 from https://ipscell.com/rmat-list/
[8] Sietsema WK, Lambert JL. Regulatory Intelligence: Update on RMAT designations. Regulatory Focus. July 2020. Regulatory Affairs Professionals Society.
[9] 21st Century Cures Act. Retrieve Sept 10, 2019 from https://www.congress.gov/114/bills/hr34/BILLS-114hr34enr.pdf
[10] FDA. Guidance for Industry. Expedited Programs for Regenerative Medicine Therapies for Serious Conditions. Feb, 2019. Retrieved Sept 10, 2019 from https://www.fda.gov/media/120267/download
[11] 药明康德内容团队. 四手联弹:FDA CDER、CBER主任解读加快药品审评. Sept 18, 2019. Retrieved Sept 18, 2019 from https://www.sohu.com/a/341751257_282570
[12] 药明康德内容团队. 回眸FDA药品审评改革35年,百尺竿头,如何更进一步?Mar 14, 2020. Retrieved Mar 14, 2020 from https://www.sohu.com/a/379958223_282570
[13] Peter Marks. This is Not a Test: RMAT Designation Goes Live. Mar 21, 2017. Retrieved Mar 22, 2017 from https://www.fda.gov/news-events/fda-voices/not-test-rmat-designation-goes-live
[14] 宋·释普济《五灯会元》卷五十:“开花结果自馨香。”
[15] Wilson W. Bryan. Regenerative Medicine Advanced Therapy (RMAT) Designation. Sept 13, 2018. Retrieved Sept 22, 2018 from https://www.asgct.org/getattachment/Advocacy/Government-Relations-Publications/Bryan-RMAT.pdf.aspx?lang=en-US
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。














 个人中心
个人中心
 我是园区
我是园区




