2021年1月13日,来自哈佛大学医学院/波士顿儿童医院的 Frederick W. Alt团队在 Nature杂志发表了题为
Loop Extrusion Mediates Physiological Igh Locus Contraction for RAG Scanning
的研究文章
(本文第一作者兼共同通讯作者为
代海强
博士,
Hongli Hu
和
Cheng-Sheng Lee
分别为共同一作和共同通讯作者)
。该文章通过构建超长VH区域翻转小鼠模型,
揭示了生理条件下小鼠祖B细胞中黏连蛋白cohesin控制的染色质环挤出介导免疫球蛋白重链基因(Igh)位点收缩,同时驱动RAG重组酶远程线性扫描染色质,并且进一步揭示了cohesin释放因子WAPL在该机制中调控生理条件下VH基因片段多样化重组的重要机理,此项工作为该领域长期存在的核心问题提供了更加清晰而全面的认识。

该实验室近年来一系列基于v-Abl转化的小鼠祖B细胞
(v-Abl-transformed progenitor (pro) B cells)
的研究表明,当RAG结合在重组中心
(recombination centre, RC)
JH重组信号序列
(recombination signal sequence, RSS)
时, cohesin控制的染色质环挤出
(chromatin loop extrusion)
驱动RAG染色质扫描
(RAG chromatin scanning)
不但可以介导D-to-JH重组,还可以介导方向相对的RSSs和cryptic RSSs重组。RAG从重组中心DJH-RC-RSS线性扫描到其上游方向相对的VH-RSSs时受到CTCF结合元件
(CTCF-binding elements, CBEs)
的阻碍。对于生理条件下原代祖B细胞
(primary progenitor (pro) B cells)
2.4-Mb VH区域如何发生位点收缩
(locus contraction)
,以及VH区域远端数以百计的功能性VH基因片段是如何与DJH-RC重组的等问题仍不清楚。长久以来,人们一直认为原代pro-B细胞远端VHs通过VH区域位点收缩,依靠随机扩散
(diffusion)
进入重组中心和DJH-RC-RSS进行重组。
为了研究cohesin控制的染色质环挤出在生理条件下对小鼠原代pro-B细胞IgH位点收缩和长距离范围内VH多样化重组的作用机理,作者巧妙地将小鼠2.4-Mb VH区域进行翻转,改变了对应区域内所有VHs和它们的VH-RSSs相对重组中心DJH-RC-RSS的方向,只保留近端一个功能性的VH81X作为实验对照,结果意外的发现超长VH翻转区域里真实的
(bona fide)
VH-RSSs几乎不再进行重组。虽然该结果可以很好的说明VH-RSS的重组是通过RAG线性扫描染色质介导的,但是也有可能这种超长VH区域翻转破坏了IgH位点收缩,或者以某种方式阻碍了VH-RSS向重组中心DJH-RC-RSS的随机扩散。
该实验室前期有关RAG 介导的off-target研究发现,cryptic RSSs序列可以短到只需是真实RSS序列中CAC三个碱基,只要方向和重组中心RSS方向相对,RAG就可以切割。因此,作者进一步对比分析了正常和VH区域翻转小鼠原代pro-B细胞中cryptic RSSs重组情况,发现正常2.4-Mb VH区域内cryptic RSSs,当方向和重组中心DJH-RC-RSS相对时,则发生重组,反之则不会,这些结果进一步支持了小鼠原代pro-B细胞内RAG染色质线性扫描整个VH区域。另外,VH区域翻转小鼠提供了更加严格的验证RAG线性扫描的检测模型,令作者惊讶的是,VH区域翻转虽然消除了原本和重组中心相对的cryptic RSSs的重组,但却激活了对原本反向的cryptic RSS的重组,而且RAG沿着染色质一直扫描,超出了VH区域,并通过IgH上游多个会聚型CBE染色质结构域直到端粒
(图1)
。为了检测2.4-Mb VH区域翻转对IgH位点收缩的影响,作者通过3C-HTGTS检测正常和VH区域翻转小鼠原代RAG1缺失pro-B细胞内重组中心和整个VH区域的相互作用,发现VH翻转并没有破坏IgH位点收缩,同时染色质环挤出相关结合蛋白和IgH转录水平均没有受影响。这些研究发现强力地支持在小鼠原代pro-B细胞中cohesin控制的染色质环挤出驱动RAG染色质线性扫描上游的VH区域,从而介导VH-to-DJH的多样化重组。
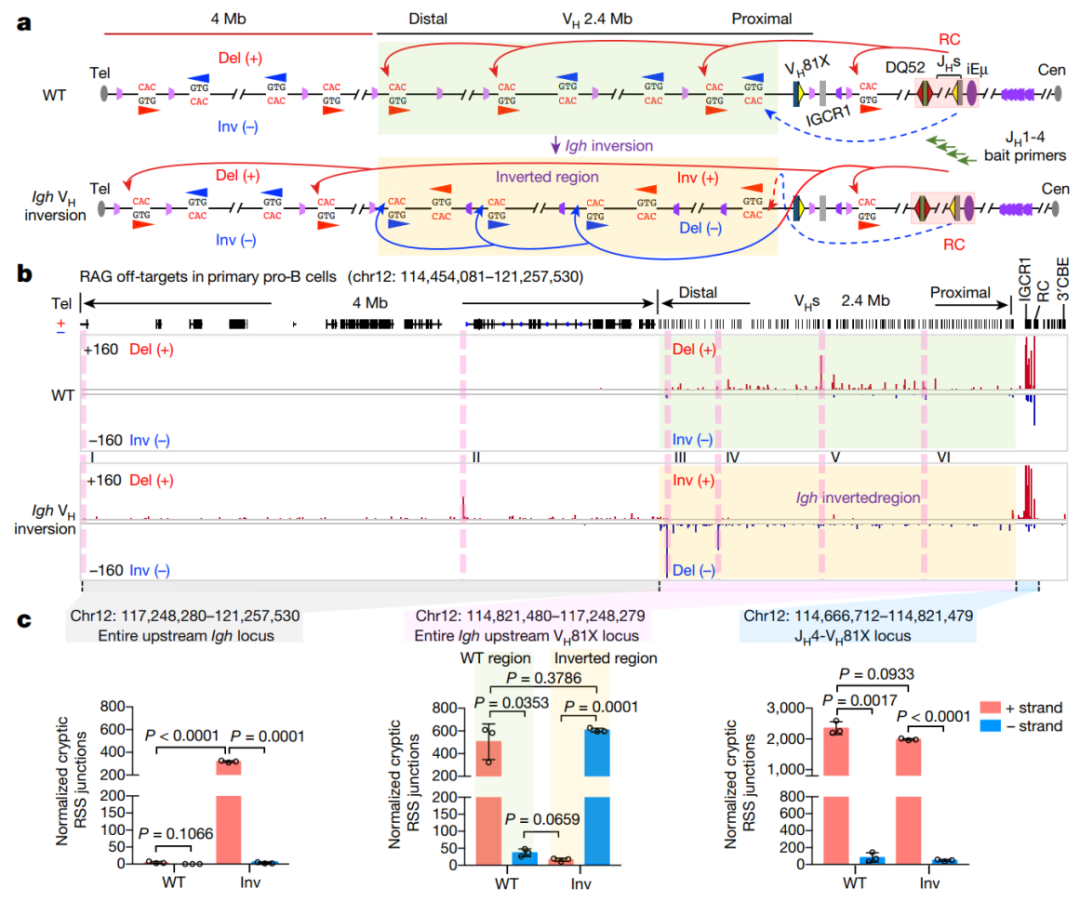 图1 正常和VH区域翻转小鼠原代pro-B细胞中cryptic RSSs重组情况分析
图1 正常和VH区域翻转小鼠原代pro-B细胞中cryptic RSSs重组情况分析
超长VH区域翻转激活RAG沿着染色质一直扫描,超出VH区域,并通过IgH上游多个会聚型CBE锚定的染色质结构域直到端粒,这种表型确实好的令人难以置信,同时也表明在原代pro-B细胞中存在某种机制可以在整个基因组中
(不仅局限于VH区域)
广泛的解除CTCF/CBE的阻滞效应,从而允许cohesin调控的染色质环挤出驱动RAG长距离线性扫描染色质。为了阐明参与IgH位点收缩和远端VH重组的关键因子,作者对小鼠原代pro-B细胞和G1期v-Abl pro-B细胞进行了转录组分析,发现在参与染色质环挤出的cohesin复合物因子中,cohesin释放因子WAPL在小鼠原代pro-B细胞中表达非常低。和IgH位点收缩和RAG染色质扫描相关,之前在多种其它细胞中已证实WAPL水平下调能够延伸CTCF锚定的染色质环状结构域。因此,作者推测小鼠原代pro-B细胞很可能通过下调cohesin释放因子WAPL,介导IgH位点收缩和RAG长距离扫描VH染色质区域。
为了直接检测WAPL阻碍IgH位点收缩和VH-to-DJH重组的能力,作者在v-Abl pro-B细胞中构建了WAPL-degron降解体系。v-Abl pro-B细胞系经诱导后能长期稳定生存于G1期,并能大量激活RAG介导的D-to- JH重组,但VH-DJH重组很少,且远端VH位点未收缩且缺乏与重组中心的相互作用。相应的,作者通过降解G1期v-Abl pro-B细胞中WAPL,不但激活VH位点收缩,还大量激活RAG线性扫描介导的远端VH-to-DJH重组,该研究结果提供了直接的证据表明WAPL表达下调可以同时激活IgH位点收缩和VH-to-DJH重组。作者同时也翻转了v-Abl pro-B细胞2.4-Mb的VH区域,进一步的研究发现v-Abl pro-B细胞超长VH区域翻转对于真实VH-RSS和cryptic RSS重组的影响和对应的小鼠原代pro-B细胞是一样的,包括延伸VH上游cryptic RSSs重组直到端粒。这些研究发现进一步强力的支持WAPL表达下调促进IgH位点收缩和RAG方向特异的线性扫描VH区域。
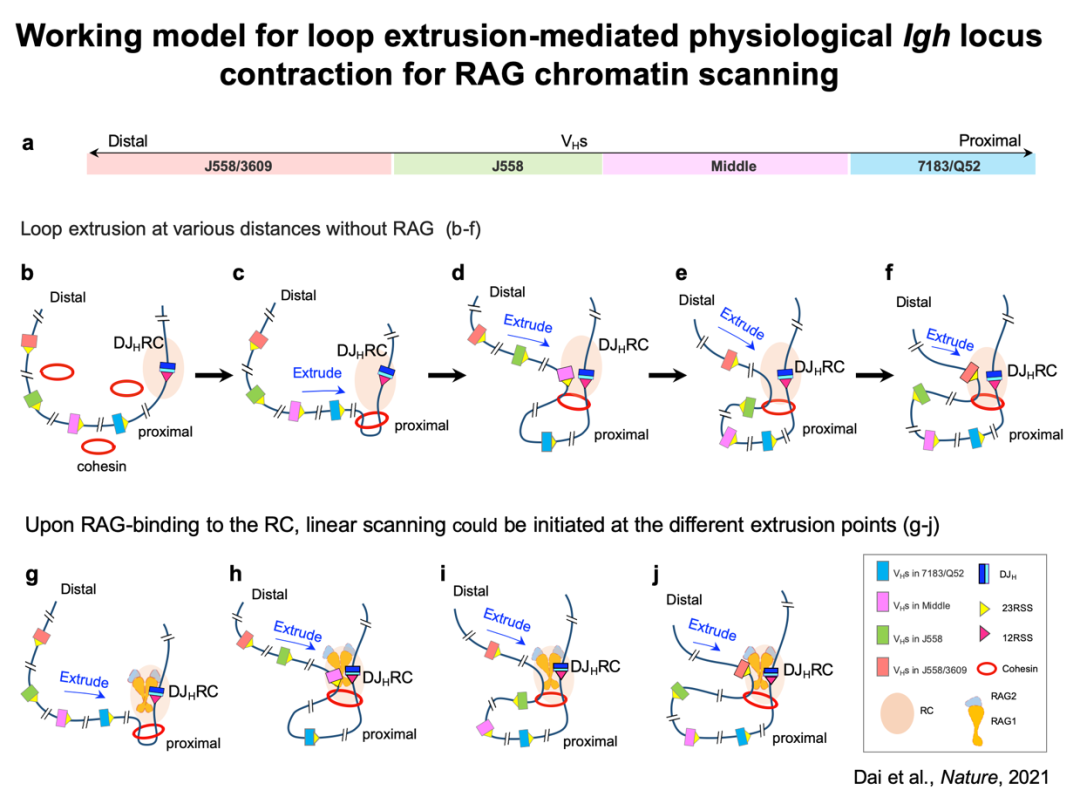 图2 染色质环挤出介导IgH位点收缩和RAG染色质扫描模型
图2 染色质环挤出介导IgH位点收缩和RAG染色质扫描模型
该实验室之前的研究发现,没有结合RAG的新生重组中心
(nascent RC)
充当环挤出障碍,为上游染色质通过重组中心的挤出提供了“动态”下游锚点。然而,RAG与新生重组中心的结合可能增强正在被扫描的上游染色质中的阻碍作用,因此挤出作用不会延伸那么远。基于上述实验发现和分析,研究者针对小鼠原代pro-B细胞提出了一个全新的cohesin介导染色质环挤出驱动IgH位点紧缩和RAG染色质扫描的模型
(图2)
。新生的
(未与RAG结合的)
DJH-RC进行的环挤出比上游将RAG结合到RC时覆盖的上游染色质
(随细胞而异)
的距离要大得多。如果RAG随后在此类细胞中与DJH-RC结合,它可能会形成活跃的DJH-RC,从而可以在整个VH区域的不同挤出点处启动环挤出介导的RAG染色质扫描,从而避免了下游的重排和潜在的障碍。这些细胞可提供对VH区域所有VHs的更均等的扫描访问,从而实现V(D)J重组并有助于形成多样化抗体库。
综上所述,
该研究为生理条件下小鼠原代pro-B细胞IgH位点收缩和V(D)J重组的调控机理提供了更加清晰而全面的认识。同时本研究关于调控cohesin介导染色质环挤出的机制可能对基因表达的调控具有更普遍的意义。文章进一步还发现,不同于本研究关于IgH的调控机制,免疫球蛋白轻链Igk 采用的位点收缩和重组机制仍然不清楚,为未来该领域又提出了新的引人入胜的科学问题。
https://doi.org/10.1038/s41586-020-03121-7
1. Zhang, Y. et al. The fundamental role of chromatin loop extrusion in physiological V(D)J recombination. Nature 573, 600–604 (2019).
2. Hu, J. et al. Chromosomal Loop Domains Direct the Recombination of Antigen Receptor Genes. Cell 163, 947–959 (2015).
3. Jain, S., Ba, Z., Zhang, Y., Dai, H.-Q. & Alt, F. W. CTCF-Binding Elements Mediate Accessibility of RAG Substrates During Chromatin Scanning. Cell174, 102–116.e14 (2018).
4. Hill, L., et al. Wapl repression by Pax5 promotes V gene recombination by Igh loop extrusion. Nature doi: 10.1038/s41586-020-2454-y (2020).


 图1 正常和VH区域翻转小鼠原代pro-B细胞中cryptic RSSs重组情况分析
图1 正常和VH区域翻转小鼠原代pro-B细胞中cryptic RSSs重组情况分析 图2 染色质环挤出介导IgH位点收缩和RAG染色质扫描模型
图2 染色质环挤出介导IgH位点收缩和RAG染色质扫描模型
 药选址
药选址

 图1 正常和VH区域翻转小鼠原代pro-B细胞中cryptic RSSs重组情况分析
图1 正常和VH区域翻转小鼠原代pro-B细胞中cryptic RSSs重组情况分析 图2 染色质环挤出介导IgH位点收缩和RAG染色质扫描模型
图2 染色质环挤出介导IgH位点收缩和RAG染色质扫描模型