礼来口服SERD在中国启动3期临床,治疗乳腺癌
收藏
关键词:
临床期临床
资讯来源:医药观澜 + 订阅账号
发布时间:
2022-07-13
▎药明康德内容团队报道
7月11日,中国药物临床试验登记与信息公示平台显示,礼来公司(Eli Lilly and Company)已启动一项国际多中心(含中国)3期临床试验,以评估口服选择性雌激素受体降解剂(SERD)imlunestrant治疗ER+/HER2-局部晚期或转移性乳腺癌患者的效果和安全性。该研究将在33家临床试验机构进行,其中包括30家中国临床试验机构。研究计划在国际入组800人,在中国境内入组120人。
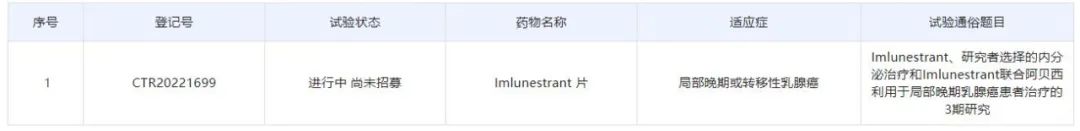
截图来源:药物临床试验登记与信息公示平台
ER+/HER2-乳腺癌指的是那些肿瘤细胞表达雌激素受体(ER)但不表达人表皮生长因子受体2(HER2)的乳腺癌亚型,这类患者约占了总乳腺癌患者的70%左右。在初期,这类乳腺癌病患可以通过内分泌阻断疗法治疗。但是随着疾病进展,患者会对此疗法产生抗性,同时也会累积许多突变,造成治疗上的困难。
SERD是治疗ER+/HER2-乳腺癌患者的有效疗法之一。SERD是一种小分子,它们通过与癌细胞表面的雌激素受体相结合,降低雌激素受体的稳定性,诱导它们被细胞正常的蛋白降解机制降解,从而降低雌激素受体水平,抑制癌细胞的生长。与抑制雌激素活性的调节剂不同,SERD理论上通过介导雌激素受体的降解,能够更为全面地抑制雌激素受体的功能,并且可能解决雌激素受体突变产生的耐药性。
最早获批的SERD需要通过注射给药的SERD。由于注射剂型可能会限制这类疗法的使用范围,近年来研究人员已开始研发新一代的口服剂型SERD。
Imlunestrant正是礼来公司开发的一款口服选择性SERD。此前,它已在接受过多种前期疗法治疗的晚期乳腺癌患者中表现出早期疗效信号。目前,礼来公司正在3期临床中评估imlunestrant的疗效。
根据中国药物临床试验登记与信息公示平台,礼来本次登记的是一项随机、开放的国际多中心3期临床。试验的目的包括两个:一是确定在既往接受芳香化酶抑制剂联合或不联合CDK4/6抑制剂治疗的ER+/HER2-局部晚期或转移性乳腺癌患者中,评估imlunestrant与研究者选择的内分泌治疗相比是否会延长患者的无进展生存期(PFS);二是评估相较于imlunestrant单药治疗,imlunestrant联合CDK4/6抑制剂阿贝西利是否会延长患者的PFS。
[1] 中国药物临床试验登记与信息公示平台.
Retrieved July 12,2022, from http://www.chinadrugtrials.org.cn/index.html
本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。







 个人中心
个人中心
 我是园区
我是园区




