精彩内容
据美国食品和药物管理局(FDA)的数据统计,4月审批速度依旧给力,FDA共批准4款创新药物。2021年至今,FDA已陆续批准了20款创新药物,其中15款为新分子实体,3款为新生物制品,2款为细胞疗法。
近十年FDA批准的新药数量
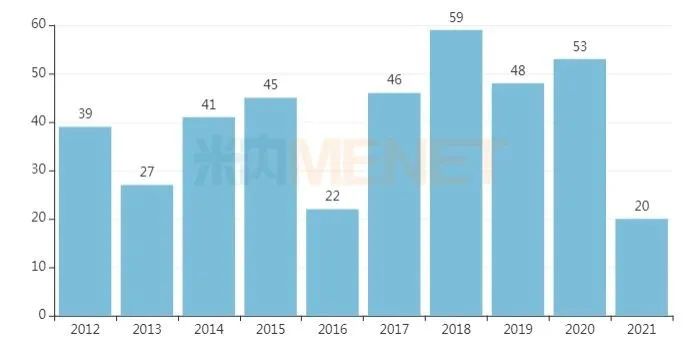 来源:FDA网站、公开资料
来源:FDA网站、公开资料
2021年4月,FDA共计批准4款创新药物,包括近10年来FDA批准的首个新型非兴奋剂类治疗注意力缺陷多动障碍药物Qelbree(viloxazine);首款包含雌甾醇的避孕药物Nextstellis(屈螺酮;雌甾醇);首款获得FDA批准用于治疗子宫内膜癌的PD-1疗法Jemperli(dostarlimab);首款也是唯一一款获批的CD19靶向抗体偶联药物Zynlonta(loncastuximab tesirine)。
美国药物市场是医药产业市场规模最大、市场化程度最高的市场,因此在美国获批上市的创新药物足以成为全球创新药物研发的风向标。4月,FDA再次批准PD-1药物和ADC药物,而越来越多的热门领域药物接连上市,让研发企业看到市场的可利性,如今PD-1药物和ADC药物是全球多家制药企业的重要研发对象。
FDA批准新药的详细信息

Qelbree(viloxazine)
2021年4月2日,美国FDA批准Supernus生物制药公司研发的口服药物Qelbree(viloxazine)上市,用于治疗6-17岁儿童的注意力缺陷多动障碍(ADHD),Qelbree是近10年来FDA批准的首个新型非兴奋剂类ADHD药物。
viloxazine具体信息
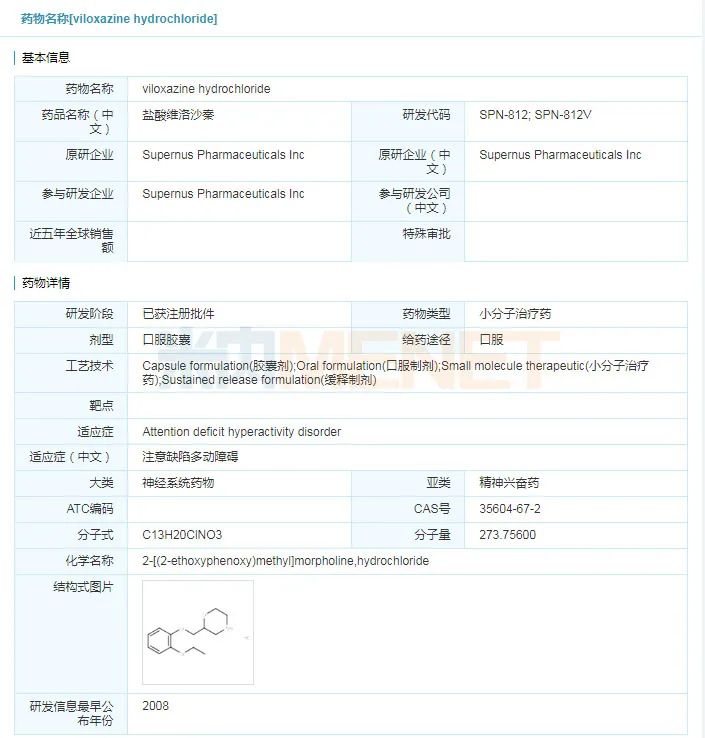
来源:米内网全球药物研发库
ADHD俗称“多动症”,表现为与同龄儿童相比明显的注意力集中困难,注意持续时间短暂,活动过度或冲动的一组综合征。而且症状基本在学前出现,随着年龄的增长,共患学习障碍和其他心理障碍的概率明显增加。美国疾病控制和预防中心统计,ADHD影响着大约600万的美国儿童和青少年。目前,有三类治疗ADHD药物活跃在市场上,分别是兴奋剂、非兴奋剂和抗抑郁类药物。兴奋剂作为一线ADHD治疗药物,使用历史已经长达几十年,而非兴奋剂ADHD药物可以在兴奋剂不起作用或产生严重副作用的情况下用于患者的治疗。
四项针对6-17岁儿童患者III期临床试验为Qelbree的获批奠定基础,超过1000名患者参与此次研究。研究结果显示,四项研究均达到主要终点,与安慰剂组相比,使用Qelbree不同剂量组患者ADHD 5级评定量表(ADHD Rating Scale-5)评分较基线变化值显著性差异,患者多动/冲动和注意力不集中症状得到显著改善。
Nextstellis(屈螺酮;雌甾醇)
2021年4月15日,美国FDA宣布批准Mayne制药公司的复方片剂Nextstellis(屈螺酮;雌甾醇)上市,用于预防怀孕。Nextstellis是首款包含雌甾醇(estetrol, E4)的避孕药物,也是美国FDA超过50年来首次批准的一款新的雌激素。
estetrol+drospirenone具体信息
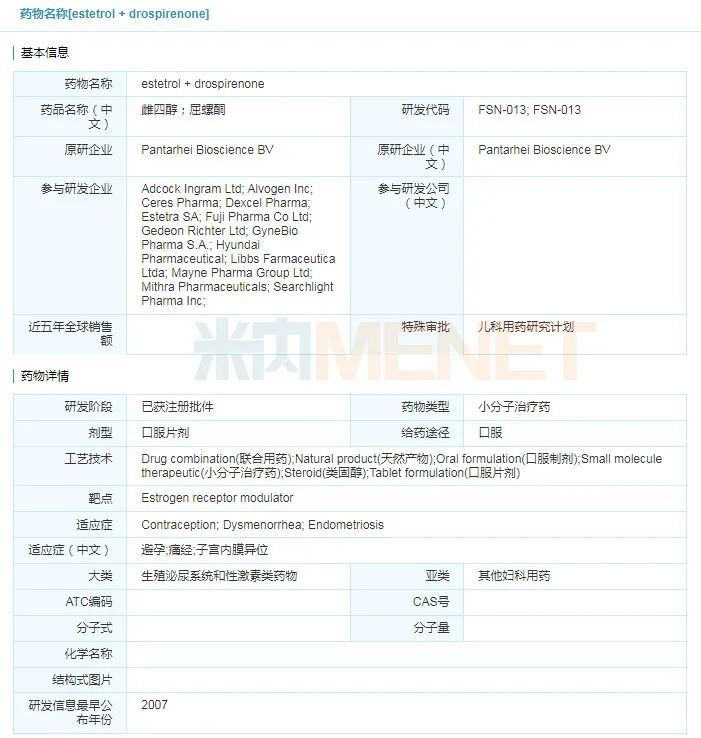
来源:米内网全球药物研发库
药物避孕是欧美国家女性预防怀孕的重要手段,在美国,近1000万女性使用短效复合避孕药。目前,超过99%的短效避孕药都含有乙炔雌二醇(EE),一种可以广泛结合体内所有雌激素受体的人工合成雌激素。Nextstellis的独特之处在于使用了雌甾醇。雌甾醇是一种天然雌激素,能够选择性地与身体中的特定组织结合,不仅可以有效预防怀孕,还可以减少雌激素可能带来的副作用。
Nextstellis在多项临床试验中的优越表现为此次批准奠定基础。在对3725名女性进行的两项III期临床试验中,Nextstellis表现出良好的效力,达到了主要避孕终点,且同时达到各种次要终点。除此之外,Nextstellis被证明有良好的周期控制、出血控制、安全性和耐受性。
Jemperli(dostarlimab)
2021年4月22日,美国FDA批准葛兰素史克公司开发的Jemperli(dostarlimab)上市,用于治疗接受含铂化疗期间或之后病情进展、错配修复缺陷(dMMR)复发性或晚期子宫内膜癌患者。这是首款获得FDA批准用于治疗子宫内膜癌的PD-1疗法。Jemperli之前还被FDA授予了突破性药物资格和优先审查资格,其新药申请通过加速审批程序获得批准。5月3日,Jemperli通过接受欧洲药品管理局(EMA)的审查,正式获得欧盟委员会(EC)批准用于治疗子宫内膜癌。
dostarlimab具体信息
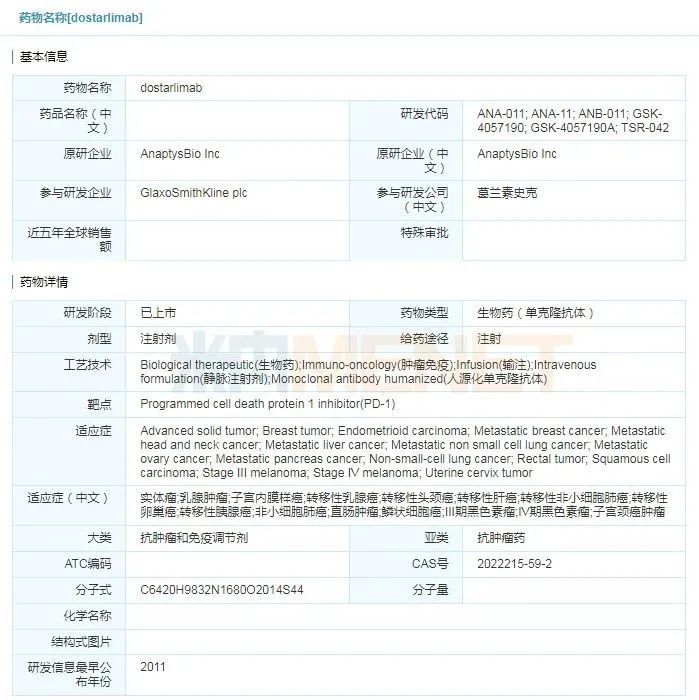
来源:米内网全球药物研发库
子宫内膜癌是发生于子宫内膜的恶性肿瘤。在美国,子宫内膜癌已经成为最常见的女性生殖系统恶性肿瘤,其发病率呈上升趋势。子宫内膜癌在我国居女性生殖系统恶性肿瘤排第二位,据2015年国家癌症中心统计,我国发病率为63.4/10万,死亡率21.8/10万。
Jemperli的安全性和有效性在一项名为GARNET单臂、多队列的临床试验中得到验证。结果显示,在接受Jemperli治疗的71例复发或晚期dMMR子宫内膜癌患者中,有42.3%的患者病情达到总缓解率(ORR),其中完全缓解率(CR)为12.7%,部分缓解率(PR)为29.6%。在病情缓解的患者中,93%的患者缓解持续时间可超过6个月。
自2014年以来,全球共批准上市了11款PD-1/PD-L1药物,其中包括4款只在中国上市的国产PD-1单抗,Jemperli成为全球第7款PD-1药物。
PD-1/PD-L1赛道越发拥挤,但为了在庞大的市场里分羹一杯,国内的PD-1/L1单抗呈现扎堆研发的状态,多家PD-1/PD-L1处于已申请上市阶段。誉衡药业的赛帕利单抗也于2020年2月递交了上市申请;正大天晴与康方生物在2020年5月也递交了派安普利单抗注射液的上市申请;康宁杰瑞生物与思路迪医药、先声药业达成战略合作的重组人源化PD-L1单域抗体恩沃利单抗注射液的生物制品上市许可申请已于2020年12月17日获国家药监局受理;2021年4月28日,复宏汉霖宣布,公司自主研制的PD-1抑制剂斯鲁利单抗针对经标准治疗失败的、不可切除或转移性高度微卫星不稳定型(MSI-H)实体瘤适应症的上市注册申请正式纳入优先审评审批程序。未来,获批上市的国产PD-1/PD-L1第二梯队领头者很快就会出现。
已上市PD-1/L1药物信息

Zynlonta(loncastuximab tesirine)
2021年4月23日,美国FDA加速批准ADC Therapeutics公司的抗体偶联药物(ADC)Zynlonta(loncastuximab tesirine)上市,用于治疗已接受过两种或多种系统疗法的复发或难治性(r/r)大B细胞淋巴瘤(LBCL)成人患者,包括弥漫性大B细胞淋巴瘤(DLBCL)、起源于低级别淋巴瘤和高级别细胞淋巴瘤的弥漫性大B细胞淋巴瘤。Zynlonta是首款也是唯一一款获得FDA批准CD19靶向ADC药物,该药还曾获得FDA授予的优先审查资格。
loncastuximab tesirine具体信息
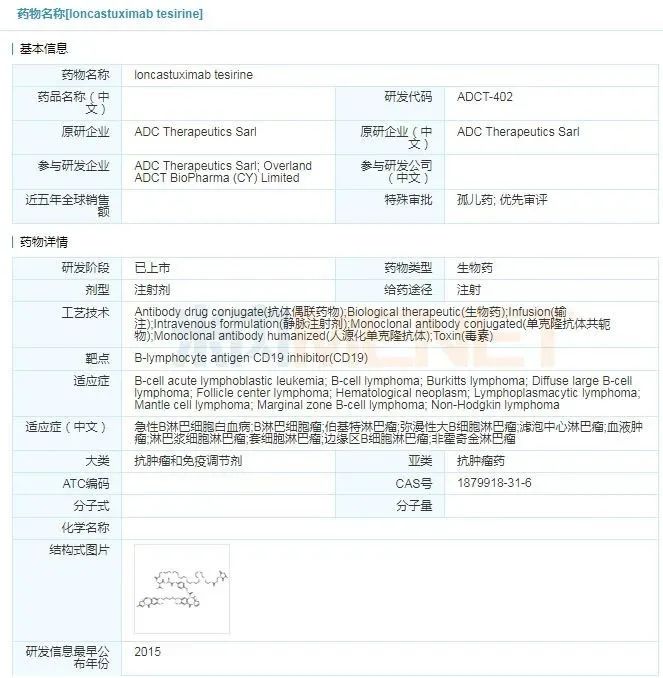
来源:米内网全球药物研发库
此次批准主要基于一项名为Lotis-2的多中心、开放标签、单臂II期临床试验。145例复发或难治性弥漫性大B细胞淋巴瘤或高级别B细胞淋巴瘤的成人患者参与此项研究,并进行了至少两次全身治疗。结果显示,接受Zynlonta治疗的患者有48.3%达到了总缓解率(ORR),其中完全缓解率(CR)达到了24.1%,部分缓解率(PR)达到了24.1%。在得到缓解的70例患者中,中位缓解时间为10.3个月。
近两年,ADC打了场漂亮的“翻身仗”,如今已成为全球的热门研究领域。至今,包括loncastuximab tesirine在内,全球已有11款ADC药物获批上市,其中10款均获得美国FDA批准,而Akalux(cetuximab sarotalocan)目前在日本附条件批准上市,用于头颈癌的治疗。此前上市的ADC药物靶点涉及CD33、CD30、HER2、CD22、CD79b、Nectin-4、TROP2、BCMA和EGFR,此次上市的Zynlonta开辟新的靶点研究方向CD19,为抗肿瘤药物又增一新型炮弹。
已上市ADC药物信息

来源:米内网全球药物研发库、米内网全球上市药物库
注:资料来源于FDA官网、企业公告、米内网数据库
如有错漏,敬请指正。
本文为原创稿件,转载请注明来源和作者,否则将追究侵权责任。
投稿及报料请发邮件到495903287@qq.com
稿件要求详询米内微信首页菜单栏
商务及内容合作可联系QQ:412539092




 个人中心
个人中心
 我是园区
我是园区




